
 甲醇是人们开发和利用的一种新能源.已知:
甲醇是人们开发和利用的一种新能源.已知:分析 (1)②+①得CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l),依据盖斯定律计算反应热,写出热化学方程式;
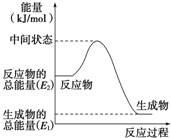
(2)反应焓变△H=生成物总能量-反应物总能量;
(3)燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量.
解答 解:(1)①2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol;
②CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2(g)△H2=-192.9kJ/mol;
由盖斯定律②+①得到甲醇蒸气完全燃烧的热化学反应方程式为:CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O△H2=-764.7kJ/mol;
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H2=-764.7kJ/mol;
(2)反应物总能量大于生成物总能量,为放热反应,反应②中的能量变化如图所示,依据图象分析,反应焓变△H=生成物总能量-反应物总能量,△H2=E1-E2,
故答案为:放;E1-E2kJ•mol-1;
(3)燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol,则氢气燃烧热为285.9KJ/mol,
故答案为:285.9 kJ•mol-1.
点评 本题考查反应热与能量,为高频考点,题目涉及反应热的计算、热化学方程式的书写、燃烧热的概念,明确盖斯定律计算反应热的方法是解题关键,题目难度不大.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
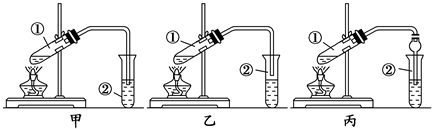
在通风厨中进行下列实验,下列说法不正确的是( )
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
A.I中气体由无色变为红棕色的化学方程式:2NO+O2===2NO2
B.II中的现象说明Fe表面形成致密的氧化膜,阻止Fe进一步反应
C.对比I、II中的现象,说明稀HNO3的氧化性强于浓HNO3
D.针对III中的现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
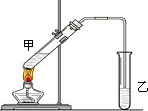 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: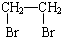 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
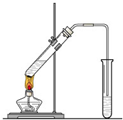 在实验室我们也可以用右图所示的装置制取乙酸乙酯.
在实验室我们也可以用右图所示的装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
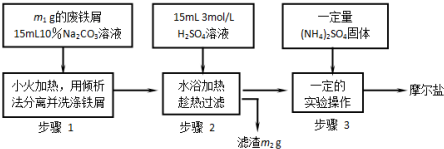
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com