
下列说法正确的是( )
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是
2H2(g)+O2(g)===2H2O(l) ΔH=-483.6 kJ
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480 mL含 NaClO 25%,密度为1.19 g/cm3的消毒液。下列说法正确的是 ( )
A.定容摇匀后,有少量溶液外流,则NaClO的物质的量浓度偏小
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小
D.需要称量的NaClO固体的质量为142.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是( )
A.Fe3+、Cl-、I-、Na+
B.NH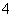 、Al3+、NO
、Al3+、NO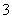 、Cl-
、Cl-
C.Ca2+、K+、Cl-、CO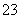
D.K+、H+、F-、SO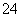
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产流程如下:
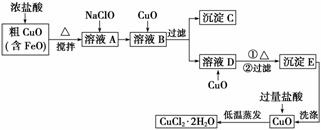
(1)浓盐酸溶解粗CuO时可能发生的离子方程式______________、____________。
(2)写出向溶液A中加入NaClO的离子方程式:__________________________________。
(3)用沉淀C制取FeCO3的流程如下:
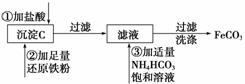
完成上述转化过程中的离子方程式
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、CO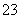 、SO
、SO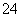 ,现取两份100 mL溶液进行如下实验:
,现取两份100 mL溶液进行如下实验:
实验1:向第一份溶液中加入足量AgNO3溶液,干燥得沉淀3.50 g。
实验2:向第二份溶液中加入足量BaCl2溶液后,干燥得沉淀2.33 g,经足量盐酸洗涤、干燥后,沉淀质量不变。
根据上述实验,以下推测正确的是( )
①一定存在Mg2+ ②可能存在CO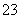 ③一定存在Cl- ④可能存在Ba2+ ⑤可能存在Mg2+
③一定存在Cl- ④可能存在Ba2+ ⑤可能存在Mg2+
A.①③ B.②③
C.③⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在100 kPa和298 K时,有关反应的热化学方程式有:
H2(g)+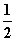 O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
H2(g)+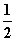 O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
下列说法错误的是( )
A.H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量
B.O2前面的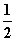 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
C.1mol物质完全燃烧生成稳定氧化物时放出的热量为燃烧热,H2的燃烧热为285.8 kJ·mol-1
D.1 mol液态水变成水蒸气时吸收44 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是常温下某些一元弱酸的电离常数:
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 6.2×10-10 | 6.8×10-4 | 1.7×10-5 | 6.4×10-6 |
则0.1 mol·L-1的下列溶液中,pH最小的是( )
A.HCN B.HF C.CH3COOH D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O  H3O++Cl- ②AlCl3+3H2O =Al(OH)3+3HCl
H3O++Cl- ②AlCl3+3H2O =Al(OH)3+3HCl
③Na2CO3+2H2O  H2CO3+2NaOH ④碳酸氢钠溶液:HCO3-+H2O
H2CO3+2NaOH ④碳酸氢钠溶液:HCO3-+H2O  CO32-+H3O+
CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O  NH3·D2O+H+
NH3·D2O+H+
A.①②③④ B.①②③ C.②③⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
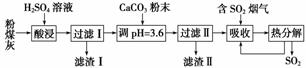
(1)酸浸时反应的化学方程式为________________________________;滤渣Ⅰ的主要成分为________________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________________________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是
________________________________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是
________________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com