
 已知在25℃条件下向10.00mL 0.1mol?L-1 HCOOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知在25℃条件下向10.00mL 0.1mol?L-1 HCOOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、a点表示的溶液中c(HCOO-)约为10-3 mol?L-1 |
| B、用25 mL的酸式滴定管量取HCOOH溶液 |
| C、c点NaOH溶液的体积小于10 mL |
| D、在a、c间任一点,溶液中一定都有c(Na+)>c(HCOO-)>c(H+)>c(OH-) |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、SiO2、CO、P2O5均为酸性氧化物 |
| B、稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C、空气、福尔马林、水玻璃、氨水均为混合物 |
| D、烧碱、冰醋酸、四氯化碳、石墨均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Mg(OH)2悬浊液中加入FeCl3溶液:3OH-+Fe3+═Fe(OH)3↓ |
| B、淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=4OH-+2I2 |
| C、用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+13H+=4Cr3++11H2O+3CH3COO- |
| D、次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向澄淸石灰水中通人过量的CO2:OH-+CO2=HCO3- |
| B、在海带灰的浸出液(含有I)中滴加H2O2得到I2:2I-+H2O2+2H+═I2+O2↑+2H2O |
| C、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═A1O2-+4NH4++2H2O |
| D、硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42++Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、33.6L氯气与27g铝充分反应,转移的电子数一定为3NA |
| B、用0.2mol Cl2溶解于10L的水中,可生成0.2NA个HClO |
| C、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D、0.012kg 13C中,含碳原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向电石中缓慢滴入饱和食盐水,可制取C2H2 |
| B、将NH4HCO3饱和溶液置于蒸发皿中加热蒸干,可制取NH4HCO3固体 |
| C、向FeCl3饱和溶液缓慢滴入过量氨水加热,可制取Fe(OH)3胶体 |
| D、将CuCl2溶液置于蒸发皿中加热蒸干,可制取无水CuCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 |
 |
 |
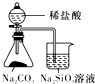 |
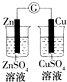
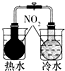
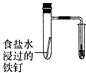
| 验证化学能转化为底电能 | 验证温度对平衡移动的影响 | 验证铁发生氢腐蚀 | 验证非金属Cl>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com