
| A. | H 和 D | B. | 02 和 03 | C. | 苯和甲苯 | D. | 乙醇和二甲醚 |
分析 A.质子数相同,质量数(或中子数)不同的原子互为同位素;
B.同种元素形成的不同单质互为同素异形体;
C.结构相似、组成上相差1个或者若干个CH2原子团的化合物互为同系物;
D.具有相同分子式而结构不同的化合物互为同分异构体;
解答 解:A.H 和 D是质子数相同,中子数不同的同种元素的不同原子是氢元素的同位素,故A错误;
B.O2和O3是同种元素组成的不同单质属于同素异形体,故B正确;
C.苯和甲苯结构相似组成相差CH2属于同系物,故C错误;
D.乙醇和二甲醚分子式相同结构不同属于同分异构体,故D错误;
故选B.
点评 本题考查“五同”比较,题目难度不大,侧重考查学生的辨别能力,选项多,要细心排查.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯水放置数天后酸性增强 | |
| B. | 新制氯水中只含氯气和水分子 | |
| C. | 新制氯水能杀菌消毒是因为氯气有毒,能毒杀细菌 | |
| D. | 光照氯水后有气泡逸出,该气体是氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的烃,下列说法中不正确的是( )
的烃,下列说法中不正确的是( )| A. | 该烃是苯的同系物 | |
| B. | 该烃的一氯代物最多有3种 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 分子中至少有6个碳原子处于同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、CaBr2:
、CaBr2: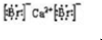 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与盐酸反应 | B. | 小苏打粉末与盐酸反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl晶体反应 | D. | 稀氨水与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性甲比乙弱 | |
| B. | 最高价氧化物的水化物的酸性甲比乙强 | |
| C. | 阴离子的还原性甲比乙弱 | |
| D. | 金属性甲比乙弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com