
下列有关说法正确的是
| A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| C.加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大 |
| D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
科目:高中化学 来源: 题型:单选题
反应H2(g)+ I2(g) 
 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键 ②单位时间内生成n molI2的同时生成2n molHI
| A.②④⑤⑥ | B.②③④⑤ | C.①③④⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
700℃时,向容积为1 L的密闭容器中充入一定量的CO2和H2,发生反应:
CO2+H2(g)  CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | n(CO2)/mol | H2/ mol |
| 0 | 1.50 | 1.00 |
| t1 | | 0.40 |
| t2 | 0.90 | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列图示与对应的叙述相符的是 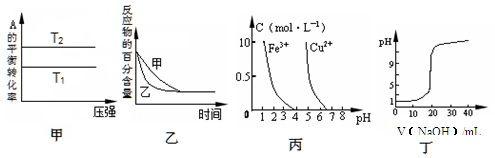
A.由图甲可以判断:对于反应aA(g)+ bB(g) cC(g),若T1>T2, 则a +b=c且 ?H<0 cC(g),若T1>T2, 则a +b=c且 ?H<0 |
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 |
| D.图丁表示用0.1000 mol/L NaOH溶液滴定20.00 mL0.1000 mol/L醋酸溶液得到的滴定曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g) XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol/(L·s)
②反应前容器内的压强与平衡后容器内的压强之比为1:1
③ 2 s 时物质A的转化率为30% ④ X="2"
其中正确的是
| A.①③④ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把下列四种x的溶液,分别加入盛有10 mL、2 mol/L的盐酸的烧杯中,并均加水稀释至50mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是:
| A.20 mL,2 mol/L | B.20 mL,3 mol/L | C.10 mL,5 mol/L | D.10 mL,3 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于反应aA+bB=dD+eE,该化学反应速率定义为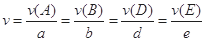 。式中
。式中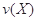 指物质
指物质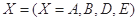 的反应速率,
的反应速率,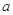 、
、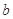 、
、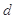 、
、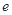 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
| 实验编号 | 1 | 2 | 3 | 4 |
| c(HI)/ mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 |
| c(H2O2)/ mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 |
| v/ mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 |
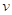 (H2O2)相等
(H2O2)相等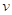 ="0.0304" mol·L-1·s-1
="0.0304" mol·L-1·s-1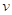 与“HI和H2O2浓度的乘积”的比值为常数
与“HI和H2O2浓度的乘积”的比值为常数查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在密闭容器中进行如下反应:X2(g)+Y2(g)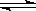 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A.Z为0.3mol/L | B.Y2为0.4mol/L | C.X2为0.2mol/L | D.Z为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于化学反应速率的说法正确的是 ( )
| A.化学反应速率是指单位时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 |
| B.化学反应速率为0.8 mol /(L·s)是指1s 时某物质的浓度为0.8mol/L |
| C.根据化学反应速率的大小可以知道化学反应进行的快慢 |
| D.决定反应速率的主要因素是反应物的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com