
| A、2:2:3 |
| B、1:1:3 |
| C、1:1:1 |
| D、3:3:1 |
| 1 |
| 3 |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥ | B、①②③ |
| C、④⑤⑥ | D、除⑤以外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
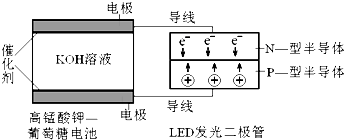
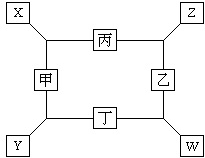 如图所示,已知:
如图所示,已知:查看答案和解析>>
科目:高中化学 来源: 题型:
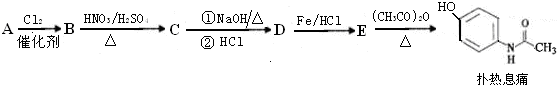

查看答案和解析>>
科目:高中化学 来源: 题型:
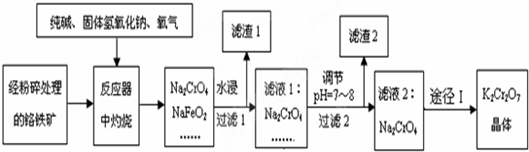
查看答案和解析>>
科目:高中化学 来源: 题型:
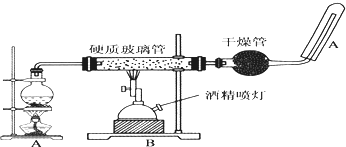
查看答案和解析>>
科目:高中化学 来源: 题型:
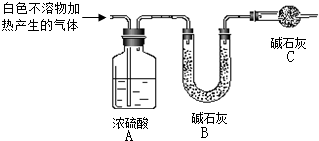 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如下实验探究反应原理并验证产物.
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如下实验探究反应原理并验证产物.| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为 |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 | 白色不溶物中含有MgCO3 | |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 |
| B、人们常采用牺牲阳极保护法防止通讯电缆发生腐蚀 |
| C、在电镀槽中,镀件做阴极,阳极选用镀层金属 |
| D、用惰性电极电解某硫酸铜溶液一段时间后,要恢复溶液的成分和浓度,可向溶液中加入一定量的氧化铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com