
| A. | 1.4 g | B. | 2.2 g | C. | 4.4 g | D. | 在2.2~4.4 g之间 |
分析 由一定质量的乙醇燃烧得到H2O的质量为10.8g,根据n=$\frac{m}{M}$计算水的物质的量,根据H原子守恒计算乙醇物质的量,根据原子守恒计算CO、CO2的总的物质的量,结合二者质量之和列方程计算各自物质的量,根据m=nM计算CO的质量.
解答 解:n(H2O)=10.8g÷18g/mol=0.6mol,
根据H原子守恒,可知乙醇的物质的量=$\frac{0.6mol×2}{6}$=0.2mol,
根据C原子守恒,可知CO和CO2的总的物质的量=0.2mol×2=0.4mol,
由于水的质量为10.8g,所以一氧化碳和二氧化碳的质量为:27.6g-10.8g=16.8g;
令CO、CO2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.4}\\{28x+44y=16.8}\end{array}\right.$
解得x=0.05,y=0.35,
所以原混合气中CO的质量为0.05mol×28g/mol=1.4g,
故选:A.
点评 本题考查混合物的有关计算,难度中等,关键是抓住化学反应前后原子守恒守恒及质量守恒解答.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题

| 物质 | SiC14 | A1C13 | FeC13 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是| A. | 普伐他汀分子中有4种含氧官能团 | |
| B. | 每个普伐他汀分子中含有13个手性碳原子 | |
| C. | 在一定条件下,普伐他汀能发生加成、取代、消去、缩聚反应 | |
| D. | 普伐他汀可以和NaOH溶液、Na2CO3溶液反应,还可以和酸性KMnO4溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
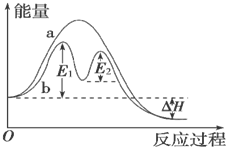
| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为放热反应,热效应等于△H | |
| C. | 改变催化剂,不能改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 16 | C. | 32 | D. | 64 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
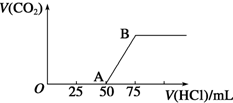 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A. | OA段所发生反应的离子方程式:H++OH-═H2O | |
| B. | NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 | |
| C. | 产生的CO2体积(标准状况下)为0.056 L | |
| D. | 原NaOH溶液的物质的量浓度为0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+).c(OH-) | B. | $\frac{c({H}^{+}).c({A}^{-})}{c(HA)}$ | C. | c(H+) | D. | pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.56mol/L | B. | 5.23mol/L | C. | 5.00mol/L | D. | 4.33mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Cl->Br- | B. | 单质的氧化性:I2<Br2 | ||
| C. | 酸性:HCl>HF | D. | 热稳定性:H2O>H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com