
【题目】已知饱和氯化铵溶液与亚硝酸钠晶体混合加热可制备氮气。利用如下装置制取氮气,并用氮气制备Ca3N2,Ca3N2遇水发生水解反应。下列说法错误的是
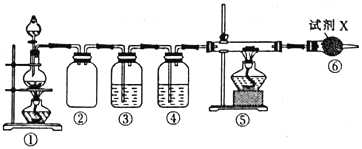
A. ①中发生的化学反应为NaNO2+NH4Cl![]() NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
B. ④、⑥中依次盛装的试剂可以是浓H2SO4、碱石灰
C. ③中盛放的试剂是NaOH 溶液
D. 实验结束,取⑤中的少量产物于试管中,加适量蒸馏水,可以使试管口湿润的红色石蕊试纸变蓝
【答案】C
【解析】A、根据题干可知,装置①为制备氮气的装置,饱和氯化铵溶液与亚硝酸钠晶体混合生成氮气、氯化钠和水,所以反应方程式为NaNO2+NH4Cl![]() NaCl+N2↑+2H2O,故A正确。B、Ca3N2遇水发生水解,所以产生的氮气需要干燥才能进入玻璃管中反应,装置④应为干燥装置,可选用浓硫酸作干燥剂;装置⑥中也应装有干燥剂,防止空气中的水蒸气进入,装置⑥中可盛放碱石灰,故B正确。C、装置中含有氧气,可利用装置③除去装置中的氧气,NaOH溶液不能除氧气,可改成酸性氯化亚铁溶液,故C错误;D、实验结束后,装置⑤中有生成的Ca3N2,Ca3N2遇水发生水解反应生成NH3和Ca(OH)2,NH3可以使湿润的红色石蕊试纸变蓝,故D正确。故选C。
NaCl+N2↑+2H2O,故A正确。B、Ca3N2遇水发生水解,所以产生的氮气需要干燥才能进入玻璃管中反应,装置④应为干燥装置,可选用浓硫酸作干燥剂;装置⑥中也应装有干燥剂,防止空气中的水蒸气进入,装置⑥中可盛放碱石灰,故B正确。C、装置中含有氧气,可利用装置③除去装置中的氧气,NaOH溶液不能除氧气,可改成酸性氯化亚铁溶液,故C错误;D、实验结束后,装置⑤中有生成的Ca3N2,Ca3N2遇水发生水解反应生成NH3和Ca(OH)2,NH3可以使湿润的红色石蕊试纸变蓝,故D正确。故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据元素周期律回答下列问题:
(1)B(硼元素)在元素周期表中与![]() 同主族,已知:
同主族,已知:![]() ,则
,则![]() 的电离方程式为___________________________________。酸性:
的电离方程式为___________________________________。酸性:![]() __________
__________![]() (填“>”或“<”)
(填“>”或“<”)
(2)![]() 和镁粉混合点燃可得单质B,该反应的化学方程式为_________________。
和镁粉混合点燃可得单质B,该反应的化学方程式为_________________。
(3)![]() 可用于生产储氢材料
可用于生产储氢材料![]() 。
。![]() 具有强还原性。在碱性条件下,
具有强还原性。在碱性条件下,![]() 与
与![]() 溶液反应可得
溶液反应可得![]() 和
和![]() ,其中H元素由
,其中H元素由![]() 价升高为
价升高为![]() 价。
价。
①写出基态![]() 核外电子排布式______________;
核外电子排布式______________;![]() 基态核外电子排布图_________________
基态核外电子排布图_________________
②基态B原子中能量最高的是__________电子,其电子云在空间呈现____________形
③写出碱性条件下,![]() 与
与![]() 溶液反应的离子方程式:__________________
溶液反应的离子方程式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000 mol·L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。[已知δ(X)=![]() ]下列说法正确的是
]下列说法正确的是
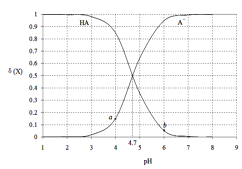
A.Ka(HA)的数量级为10-5
B.溶液中由水电离出的c(H+):a点>b点
C.当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D.当pH=7时,消耗NaOH溶液的体积为20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家的研究成果往往对人类社会的进步产生重大影响,下列对应关系错误的是( )
A.舍勒首先在实验室制得了氯气
B.氧气是戴维通过实验首先发现的
C.门捷列夫绘制了第一张元素周期表
D.侯德榜研究并使纯碱的生产实现了国产化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨。已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,通电时a电极质量增加,下列说法正确的是( )
2PbSO4+2H2O,通电时a电极质量增加,下列说法正确的是( )
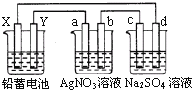
A. X极为负极
B. 放电时铅蓄电池正极的电极反应式为:PbO2+4H++SO42+4e==PbSO4+2H2O
C. c、d电极产生气体的物质的量之比为1:2
D. 电路中通过1 mol电子时,Y电极质量增加48 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
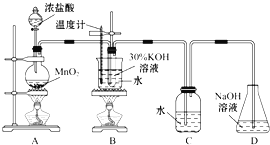
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航空材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3,不溶于水)制备TiCl4等产品的一种工艺流程示意如图:
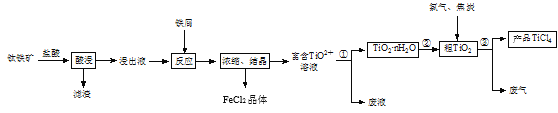
回答下列问题:
(1)“酸浸”时需要将钛铁矿粉碎,其目的是____。
(2)浸出液呈强酸性,含有TiO2+、Fe2+及少量Fe3+、Al3+等离子,则生成TiO2+的离子方程式是__。
(3)“反应”时需加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是____。
(4)通过控制条件,可以使过程①中生成的TiO2·nH2O形成一种液态分散系,用一束光照射该分散系能够产生丁达尔效应,则分散质颗粒直径的范围是____。
(5)过程①制得的固体TiO2·nH2O需用过量酸清洗以除去其中的Fe(OH)3杂质,检验Fe(OH)3杂质除净的实验方法是____。
(6)过程③生成的废气中含有CO,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是___。
(7)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是____(只要求写出一项)。
(8)依据表中信息,可采用___方法精制含少量SiCl4杂质的TiCl4。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)W在元素周期表中的位置是___。A与E组成的化合物是常用的溶剂,写出其电子式___。
(2)下列事实能用元素周期表相应规律解释的是(填字母序号)___。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.A的单质能与二氧化硅高温下制得粗品硅单质
(3)WE3的溶液可用于刻蚀铜制的印刷电路板,反应的离子方程式为____。
(4)①工业上用电解法制备D的单质,反应的化学方程式为___。
②家用“管道通”的有效成分是烧碱和D的单质,使用时需加入一定量的水,此时发生反应的化学方程式为____。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理,上述反应的离子方程式为__。上述W的氧化物X能与D的单质反应,写出该反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线a和b是可溶性一元强碱与盐酸互滴的滴定曲线,下列说法正确的是
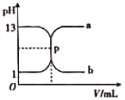
A.可溶性一元强碱、盐酸的物质的量浓度均为1mol·L-1
B.p点为滴定终点(两者恰好完全反应),溶液呈中性
C.酚酞不能用作该滴定的指示剂
D.曲线b是可溶性一元强碱滴定盐酸的滴定曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com