
【题目】短周期元素组成的单质X2、Y,标准状况下X2的密度为3.17gL-1,常温下,Y为浅黄色固体。Z是一种化合物,焰色反应呈浅紫色![]() 透过钴玻璃
透过钴玻璃![]() ;0.1molL-1Z的水溶液pH=13。X2、Y和Z之间有如下转化关系
;0.1molL-1Z的水溶液pH=13。X2、Y和Z之间有如下转化关系![]() 其他无关物质已略去
其他无关物质已略去![]() :
:
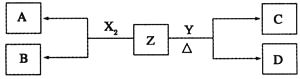
(1)写出单质X2与Z反应的离子方程式:______________________________________。
(2)已知16g单质Y完全燃烧放出148kJ热量。写出热化学方程式:________________。
(3)已知C能与较浓盐酸反应生成能使品红溶液褪色的气体
①D的化学式是:_________;D的水溶液pH>7,原因是![]() 用离子方程式表示
用离子方程式表示![]() :_____________。
:_____________。
②0.1molL-1的D溶液中各离子浓度由大到小的顺序为_______________________。
③将20mL0.5molL-1溶液逐滴加入到20mL0.2molL-1 KMnO4溶液![]() 硫酸酸化
硫酸酸化![]() 中,溶液恰好褪为无色。写出反应的离子方程式:_________________________________。
中,溶液恰好褪为无色。写出反应的离子方程式:_________________________________。
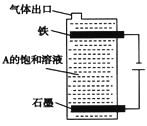
(4)①石墨和铁做电极,用隔膜电解槽电解A的溶液,阳极可产生X2。则铁做_________极。
②按下图电解A的饱和溶液,写出该电解池中较长时间内发生反应的总反应方程式: ________。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是_________。
【答案】Cl2+2OH-= Cl-+ClO-+H2O S(s)+O2 (g)=SO2 (g)H=-296kJ/mol K2S H2O + S2- HS-+OH- c(K+)>c(S2-)>c(OH-)>c(HS-)>c(H+) 5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O 阴 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 溶液先变红后褪色
2NaOH+H2↑+Cl2↑ 溶液先变红后褪色
【解析】
标准状况下X2的密度为3.17gL-1,则相对分子质量为3.17×22.4=71,应为Cl2,Y为浅黄色固体单质,应为S,Z是一种化合物,焰色反应呈浅紫色![]() 透过钴玻璃
透过钴玻璃![]() ,应含有K元素,且常温下,0.1molL-1Z的水溶液pH=13,说明Z为一元强碱,则Z为KOH,S和KOH反应生成K2SO3和K2S,已知C能与硫酸反应生成能使品红溶液褪色的气体,应为SO2,则C为K2SO3,D为K2S。
,应含有K元素,且常温下,0.1molL-1Z的水溶液pH=13,说明Z为一元强碱,则Z为KOH,S和KOH反应生成K2SO3和K2S,已知C能与硫酸反应生成能使品红溶液褪色的气体,应为SO2,则C为K2SO3,D为K2S。
(1)常温下Cl2与KOH反应的离子方程式为Cl2+2OH-= Cl-+ClO-+H2O;
(2)n(S)=![]() =0.5mol,完全燃烧生成气态产物时放出148kJ热量,则1molS完全燃烧放出296kJ的热量,热化学方程式为S(s)+O2 (g)=SO2 (g)H=-296kJ/mol;
=0.5mol,完全燃烧生成气态产物时放出148kJ热量,则1molS完全燃烧放出296kJ的热量,热化学方程式为S(s)+O2 (g)=SO2 (g)H=-296kJ/mol;
(3)S和KOH反应生成K2SO3和K2S,已知C能与硫酸反应生成能使品红溶液褪色的气体,应为SO2,则C为K2SO3,D为K2S,
①D为K2S,为强碱弱酸盐,发生H2O + S2- HS-+OH-,HS-+ H2O H2S+OH-,则溶液呈碱性,一步水解程度大于第二步水解程度,则水溶液中离子浓度由大到小顺序为c(K+)>c(S2-)>c(OH-)>c(HS-)>c(H+);
②n(SO32-)=0.02×0.5=0.01mol,n(MnO4-)=0.02×0.2=0.004mol,物质的量之比为5:2,
反应的离子方程式为5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O;
(4)①工业上常以石墨和铁分别做电极,用隔膜法电解某盐溶液来生产Cl2和NaOH,铁应作电解池的阴极;
②用电解饱和NaCl溶液的方法制取,反应的总反应方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,电解后生成的NaOH与Cl2反应生成NaClO,故滴入酚酞中,溶液先变红后褪色。
2NaOH+H2↑+Cl2↑,电解后生成的NaOH与Cl2反应生成NaClO,故滴入酚酞中,溶液先变红后褪色。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③B.密度:①<④<③<②
C.质量:④<①<③<②D.氢原子数:②<④<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z 的原子序数依次增大,W、X 原子的最外层电子数之比为 4:3,Z 原子比 X 原子的核外电子数多 4。下列说法正确的是
A.W、Y、Z 的电负性大小顺序一定是 Z>Y>W
B.W、X、Y、Z 的原子半径大小顺序可能是 W>X>Y>Z
C.Y、Z 形成的分子空间构型可能是正四面体
D.WY2 分子中![]() 键与π键的数目之比是 2:1
键与π键的数目之比是 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种常见单质,其中A、C为气体,B为常见金属.A溶于水所得的溶液可使紫色石蕊先变红后褪色.F的水溶液为浅绿色,其转化关系如图所示,请回答:
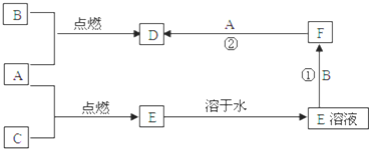
(1)![]() 和C燃烧的现象是______.
和C燃烧的现象是______.
(2)![]() 的化学式是______,检验F水溶液中金属阳离子的方法是______.
的化学式是______,检验F水溶液中金属阳离子的方法是______.
(3)反应![]() 的离子方程式是______.
的离子方程式是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对煤的综合利用,可以获得多种有机物。化合物A含有碳、氢、氧3种元素,其质量比是12:3:8。液态烃B是一种重要的化工原料,其摩尔质量为78 gmol-1。E是有芳香气味的酯。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
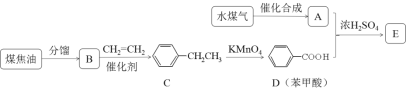
请回答:
(1)化合物A所含的官能团名称是_____________。
(2)B和CH2=CH2反应生成C的反应类型是_____________。
(3)E在氢氧化钠溶液中水解的化学方程式是_____________。
(4)下列说法正确的是_____________。
A.将铜丝在空气中灼烧后迅速插入A中,反应多次,可得到能发生银镜反应的物质
B.在一定条件下,C可通过取代反应转化为![]()
C.苯甲酸钠(常用作防腐剂)可通过D和氢氧化钠反应得到
D.共a mol的B 和D混合物在氧气中完全燃烧,消耗氧气大于7.5a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是无色透明有香味的液体,制备的实验装置如图所示。下列说法不正确的是( )
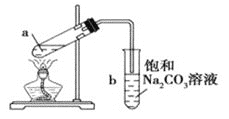
A.先在试管a中加入乙醇,然后边振荡试管边缓慢加入浓硫酸,待冷却后加入乙酸
B.浓硫酸的作用主要是催化剂和吸水剂
C.b中的饱和Na2CO3溶液可用浓NaOH溶液代替
D.试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设A、B、C代表三种元素,已知①B2―和A+两种离子具有相同的电子层结构,②C元素的原子核内质子数比B元素的原子核内质子数少8个,③B和C两种元素可形成5个原子核(一般简称5核)50个电子的负二价阴离子(提示为:BC42―或为:CB42―)。据此填空:
(1)写出B和C的元素名称:B为_____________,C为_____________。
(2)有A、B、C三种元素形成的含78个电子的盐类化合物的化学式是______________。
(3)某元素X的原子与A元素形成的化合物的化学式为:AX,通过测量发现的式量为76,X原子核内中子数为20,则X属于的元素名称是_____________,用化学符号表示X原子应该是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、锌在农药、材料和人们日常生活中具有广泛的应用。请回答下列问题:
(1)基态S原子中,核外电子占据的最高能级符号为______,其电子云形状为______,基态Zn原子的价电子排布式为______。
(2)硫代乙酰胺(CH3CSNH2)在酸性溶液中水解产生H2S,可替代H2S在溶液中作沉淀剂使用。1 mol CH3CSNH2含有π键为______mol,其中两个C原子的杂化方式分别为_______。
(3)H2S熔点为-85.5℃,而与其具有类似结构的H2O的熔点为0℃,极易结冰成固体,二者物理性质出现此差异的原因是____________________。
(4)ZnS可用于制白色的颜料及玻璃、发光粉、橡胶、塑料、发光油漆等。晶胞结构如图所示:

在一个ZnS晶胞结构中,S的数目为 ______。若该晶胞边长为540.0 pm,则其密度为_______gcm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com