
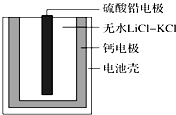
 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,Li+向负极移动 | |
| C. | 常温时,在正负极间接上电流表或检流计,指针发生偏转 | |
| D. | 每转移0.1 mol电子,理论上生成10.35g Pb |
分析 由原电池总反应可知Ca为原电池的负极,被氧化生成反应H2(g)+Cl2(g)=2HCl(g),反应的电极方程式为Ca+2Cl--2e-=CaCl2,为原电池的正极,发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,原电池工作时,阳离子向正极移动,阴离子向负极移动,结合电解方程式计算.
解答 解:A.正极发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,故A错误;
B.放电过程中阳离子向正极移动,Li+向正极移动,故B错误;
C.常温下,电解质不是熔融态,离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转,故C错误;
D.根据电极方程式PbSO4+2e-+2Li+=Li2SO4+Pb,可知每转移0.1 mol电子,理论上生成0.05molPb,质量为10.35g,故D正确;
故选D.
点评 本题考查原电池的工作原理,注意根据总反应式结合物质所含元素化合价的变化判断原电池的正负极,把握电极方程式的书写方法,易错点为C,注意把握原电池的构成条件,题目难度中等.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| B. | 将标准状况下的2.24LCO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| C. | 0.1mol•L-1的醋酸pH=a,0.01mol•L-1的醋酸pH=b,则a+1>b | |
| D. | 常温时①pH=12的氨水②pH=12的NaOH溶液,将两溶液稀释相同倍数后溶液的pH:②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH218O与D2O的混合物中所含中子数为9NA | |
| B. | 60g HCHO和CH3COOH的混合物中存在的共用电子对总数为8NA | |
| C. | 反应N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3中,当净生成0.2mol NH3生产时,在正反应中N2得到0.6NA电子 | |
| D. | 电解精炼铜中,当阴极增重3.2g时,阳极失去电子0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将体积缩小为原来的一半,当体系再次达到平衡时,C02的浓度为原来的2倍 | |
| B. | CaCO3(s)加热分解生成Ca0(s)和C02,△s<0 | |
| C. | 将体积增大为原来的2倍,再次达到平衡时,气体密度不变 | |
| D. | 保持容器体积不变,充入He,平衡向逆反应方向进行. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入少量CO2:OH-+CO2═HCO3- | |
| D. | 氯化亚铁溶液中通入氯气:Cl2+2Fe2+═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内2amol A生成,同时生成3amol B | |
| B. | A、B、C的浓度不再变化 | |
| C. | 混合气体的总压强不再变化 | |
| D. | A、B、C的分子数目比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
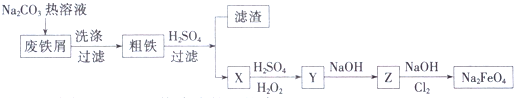
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com