
【题目】将氢氧化钡溶液滴入含1mol/L的![]() 的明矾溶液中,当生成的沉淀的物质的量最多时,铝元素的主要存在形式为( )
的明矾溶液中,当生成的沉淀的物质的量最多时,铝元素的主要存在形式为( )
A.![]() 和
和![]() B.
B.![]()
C.![]() D.
D.![]() 和
和![]()
【答案】B
【解析】
假设明矾溶液的体积为1L,则该明矾溶液中含有的离子:2molSO42-、1molAl3+和1molK+,向其中加入氢氧化钡溶液,先发生反应:2Al3++2 SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓,当铝离子和氢氧根离子恰好完全反应时,氢氧化铝的量最大,继续加入氢氧化钡溶液时,氢氧化铝和氢氧根离子反应生成偏铝酸根离子,氢氧化铝沉淀逐渐减少,发生反应:2Al(OH)3+Ba2++2OH-═2AlO2-+BaSO4↓+4H2O;可见明矾溶液中Al3+恰好沉淀完全时,生成沉淀的总的物质的量最大;故当生成的沉淀的物质的量最多时,铝元素的主要存在形式为:Al(OH)3,
故选:B。


科目:高中化学 来源: 题型:
【题目】某小组同学在实验室研究Al与CuCl2溶液的反应.
实验操作 | 实验现象 |
|
|
(1)现象![]() 中的红色物质是 ______ .
中的红色物质是 ______ .
(2)经检验现象![]() 中的无色气体为氢气.
中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因 ______.
②氢气从红色物质表面逸出的原因是 ______ .
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液![]()
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是 ______.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因 ______.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有 ______性.
②取Cu粉与1mol/LCuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.FeCl2溶液中通入Cl2:![]()
B.Ba(OH)2溶液与盐酸的反应:![]()
C.Al(OH)3沉淀中滴加盐酸:![]()
D.AlCl3溶液中加入过量氨水:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,3D-SiC@2D-MoS2异质接面催化剂具有优异的光催化CO2用纯水的全还原性能,有效实现电子/空穴的定向迁移,最终实现CO2和H2O在相应活性位点发生氧化还原反应,如图所示。下列叙述错误的是( )

A.2D-MoS2是H2O氧化的催化剂
B.H+和e-容易在SiC@MoS2催化剂间进行反应
C.中间产物的转化“HCOOH→HCHO→CH3OH”均发生还原反应
D.总反应的方程式为CO2(g)+2H2O(g)![]() CH4(g)+2O2(g)
CH4(g)+2O2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu、Zn及其化合物在生产、生活中有着重要作用。
(1)Cu、Zn在周期表中__区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式_。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因是__。
②溶液中的水存在H3O+、H5O2+等微粒形式,H5O2+可看作是H3O+与H2O通过氢键形成的离子,则H5O2+的结构式是__。
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:
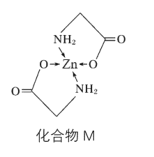
①1molM含有的σ键的数目为__。
②常见含N的配体有H2NCH2COO-、NH3、N3-等,NH3的分子空间构型为__,N3-的中心N原子杂化方式为__。
③M在人体内吸收率高的原因可能是锌形成螯合物后,电荷__(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
卤化锌/ZnX2 | ZnF2 | ZnCl2 | ZnBr2 | ZnI2 |
熔点/℃ | 872 | 283 | 394 | 445 |
则ZnX2熔点如表变化的原因是__。
(5)Zn的某种硫化物的晶胞如图所示。已知晶体密度为dgcm-3,且S2-、Zn2+相切,则Zn2+与S2+的核间距为__nm(写计算表达式)。
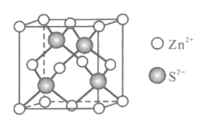
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是

A.该过程中H2O被还原生成氧气
B.该过程中涉及极性键和非极性键的断裂与生成
C.基于合成NH3的过程属于氮的固定
D.该过程的化学方程式为:2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。请按要求填空:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | ||||||||
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表列①~⑨号元素中,原子半径最大的是________(填数字序号);非金属性最强的元素是________(填数字序号);最高价氧化物对应的水化物中酸性最强的是_______(填数字序号);化学性质最稳定的是________(填数字序号)。
(2)元素③的常见氢化物的电式为_________,此氢化物与元素⑨的氢化物化合后溶于水,水溶液中离子浓度由大到小的顺序是________(用离子符号表示)。
(3)将元素⑦的单质用砂纸打磨后,滴上几滴![]() 溶液片刻后表面会形成白色毛状物,该毛状物的化学式是______________。将元素⑦的单质的粉末与铁红混合在高温下反应会放出大量热,写出该反应的化学方程式____________
溶液片刻后表面会形成白色毛状物,该毛状物的化学式是______________。将元素⑦的单质的粉末与铁红混合在高温下反应会放出大量热,写出该反应的化学方程式____________
查看答案和解析>>
科目:高中化学 来源: 题型:
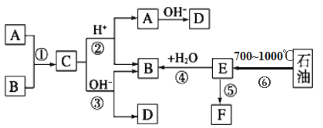
【题目】已知:A、B、F是家庭中常见的有机物,A和B碳原子数相等,E是石油化工发展水平的标志,F是一种常见的高分子材料。下面是几种物质的转化关系图:
完成下列填空:
(1)操作⑥的名称为:_____________________________________,上述反应中属于取代反应的是___________(填序号)
(2)写出比B多两个碳原子,且不能发生非燃烧性氧化反应的同系物的结构简式:___。
(3)写出反应③所用的碱液为氢氧化钠溶液,写出反应③的化学方程式____________。
(4)写出F的名称________________________,反应⑤的反应类型为_________。
(5)写出检验B的催化氧化产物的化学方程式____________,实验现象是______。
(6)写出两个既能发生银镜反应又能发生酯化反应的C的同分异构体结构简式。
________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如下图,关于绿原酸判断正确的是( )

A.1 mol绿原酸与足量NaHCO3溶液反应,生成3 mol CO2气体
B.1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2
C.1 mol绿原酸与足量NaOH溶液反应,最多消耗4 mol NaOH
D.绿原酸水解产物均可以与FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com