
| A.③⑤⑦ | B.⑤⑦ | C.③⑤ | D.⑤ |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物 |
| B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物 |
| C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子化合物 |
| D.测定SbCl3、SbCl5、SnCl4的水溶液的导电性,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
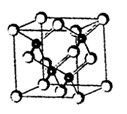
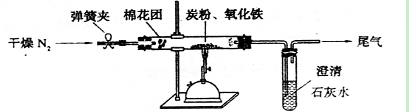
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B |
| 熔点(℃) | 801 | 714 | 190 | —70 | 2300 |
| 沸点(℃) | 1413 | 1412 | 180 | 57.57 | 2500 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。 _________________________。
_________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.[Co(NH3)4]Cl3 | B.[Co(NH3)4Cl3] |
| C.[Co(NH3)4Cl]Cl2 | D.[Co(NH3)4Cl2]Cl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 经催化剂作用变成N2和CO
经催化剂作用变成N2和CO 2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内
2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内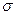 键和
键和 键的比为 。
键的比为 。| A.氢键 | B.离子键 | C.共价键 | D.配位键[E.范德华力 |
 对,则[Cu(NH3)n]+中n的值为
对,则[Cu(NH3)n]+中n的值为  。
。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com