
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。有关说法正确的是( )
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。有关说法正确的是( )
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20[] | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15[] |
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T1<T2
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
【答案】B
【解析】A.组别①中,0~20min内,v(CH4)=![]() = 0.0125 mol·Lˉ1·minˉ1,化学反应速率之比等于计量系数之比,v(NO2)=2×0.0125 =0.025mol·Lˉ1·minˉ1,错误;B. 温度越高,反应速率越快,由实验数据可知,0~20min内,组别①中甲烷的变化量为0.25 mol·Lˉ1,组别②中甲烷的变化量为0.32 mol·Lˉ1,则组别②化学反应速率大于组别①,故温度T1<T2,正确;C.温度越高,反应速率越快,达到化学平衡所需时间越少,因组别①在40min时达到化学平衡,则组别②实验在40min时一定达到化学平衡,则表格中T2对应的数据为0.15,错误;D.根据表中数据,0~10min内,组别①中甲烷的变化量为0.15 mol·Lˉ1,组别②中甲烷的变化量为0.20 mol·Lˉ1,则CH4的降解速率①<②,错误;故选B。
= 0.0125 mol·Lˉ1·minˉ1,化学反应速率之比等于计量系数之比,v(NO2)=2×0.0125 =0.025mol·Lˉ1·minˉ1,错误;B. 温度越高,反应速率越快,由实验数据可知,0~20min内,组别①中甲烷的变化量为0.25 mol·Lˉ1,组别②中甲烷的变化量为0.32 mol·Lˉ1,则组别②化学反应速率大于组别①,故温度T1<T2,正确;C.温度越高,反应速率越快,达到化学平衡所需时间越少,因组别①在40min时达到化学平衡,则组别②实验在40min时一定达到化学平衡,则表格中T2对应的数据为0.15,错误;D.根据表中数据,0~10min内,组别①中甲烷的变化量为0.15 mol·Lˉ1,组别②中甲烷的变化量为0.20 mol·Lˉ1,则CH4的降解速率①<②,错误;故选B。


科目:高中化学 来源: 题型:
【题目】标准状况下,用一定量的水吸收氨气后制得浓度为12.0 mol·L-1、密度为0.915 g·cm-3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。(本题中氨的式量以 17.0计,氨水的溶质以溶解的NH3为准,水的密度以1.00g·cm-3计)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
铜、银、金与社会生活联系密切。
(1)在周期表中, 铜、银、金位于同一族,它们基态原子的外围电子排布式的通式为__________________(用n表示电子层数),它们位于元素周期表的________区。
(2)化学上,银氨溶液可以检验醛基的存在,例如:H3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3
CH3COONH4+2Ag↓+3NH3
+H2O。1个CH3CHO分子中所含π键的数目为________,碳原子的杂化轨道类型为________;CH3 CH2OH、CH3CHO的相对分子质量仅相差2,但沸点相差很大(分别为78.5℃,20.8℃),其主要原因是________________________;NH3的VSEPR模型为________。
(3)金不溶于硝酸,但溶于“王水”,发生反应:Au+4HCl+HNO3=H[AuCl4]+NO↑+2H2O。金溶于王水的主要原因是形成了[AuCl4],提高了金的活动性。在[AuCl4]-中,金离子的配位数为________,画出该配离子的结构式:________。
(4)金、银、铜都有良好的延展性,解释其原因:________________________________。
(5)金、银的一种合金具有较强的储氢能力。该合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点。若该晶胞边长为anm,金、银原子的半径分别为bnm、cnm。则该晶胞的空间利用率(φ)
为________ (用含a、b、c和圆周率π的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际单位制的七个基本物理量之一B.二氧化碳的摩尔质量是44g/mol
C.标准状况下,22.4L水的物质的量是1molD.1mol氧气的质量是16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 molL-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
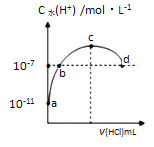
则下列说法正确的是
A. 常温下,0.1molL-1氨水的电离常数K约为1×10-5molL-1
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)=c(Cl-)
D. d点代表两溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.【查阅资料】
①硫代硫酸钠(Na2S2O3)易溶于水,在中性或碱性环境中稳定,受热、遇酸易分解。
②Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
③向Na2CO3和Na2S混合溶液中通人SO2可制得Na2S2O3(反应方程式为:![]() ,所得产品常含有少量Na2SO3和Na2SO4。
,所得产品常含有少量Na2SO3和Na2SO4。
Ⅱ.【制备产品】实验装置如图所示:
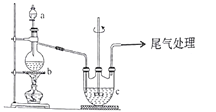
(1)实验步骤:检查装置气密性后,向三颈瓶c中加人Na2CO3和Na2S的混舍溶液,再将分液漏斗a中液体滴加到烧瓶b中加热发生反应产生SO2,请写出b中发生反应的化学方程式________。待Na2S和Na2CO3完全消耗后,结束反应。过滤c中的混合物,滤液经____(填操作名称)、过滤、洗涤、干燥、得到产品。
(2)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是_________。
III.【测定产品纯度】
称取10g产品(Na2S2O3·5H2O),配成250mL溶液,取25mL,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定。反应原理为:![]() (忽略Na2SO3与I2反应)。
(忽略Na2SO3与I2反应)。
(3)滴定至终点的现象为:____。
(4)重复三次的实验数据如左下表所示,其中第三次读数时滴定管中起始和终点的液面位置如右下图所示,则x=___mL,产品的纯度为____。

IV.【探究与反思】
(5)为验证产品中含有Na2SO3和Na2SO4该小组设计了以下实验方案,请将方案补充完整(所需试剂从稀HN03、稀H2SO4、稀盐酸、蒸馏水中选择):取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____,则可确定产品中含有Na2SO3和Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示细胞内某些有机物的元素组成和功能的关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位.请回答下列问题:

(1)图中Ⅰ在人体肝脏中是指______________.
(2)图中Ⅱ是__________,使用甲基绿、吡罗红混合染液染色Ⅲ,可使Ⅲ呈现_____色.
(3)图中P一定含有的元素是__________。P的结构通式为_________________
(4)Y和Z彻底水解都可以产生______种物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于煤和石油综合利用的叙述中,正确的是 ( )
A.煤的气化是对其进行加热直接变为气体
B.煤的干馏和石油的分馏都是化学变化
C.石油产品裂解能生产乙烯
D.石油分馏的各馏分均是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是 ( )
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com