
| m |
| M |
| V |
| Vm |
| m |
| V |
| M |
| Vm |
| 28+3×44 |
| 1+3 |
| m |
| M |
| V |
| Vm |
| m |
| V |
| M |
| Vm |
| 40 |
| 2 |
| 3.22g |
| 322g/mol |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
 [化学--选修物质结构]
[化学--选修物质结构]查看答案和解析>>
科目:高中化学 来源: 题型:
发展煤的液化技术被纳入 “十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目近日已获批复。已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇,从而实现液化。
(1)根据等电子原理,写出CO分子的结构式 。
 (2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。
(2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。
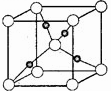
(3)右图是铜的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是 。
(5)煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛,甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 ; 1mol甲醛分子中σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
发展煤的液化技术被纳入 “十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目近日已获批复。已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇,从而实现液化。
(1)根据等电子原理,写出CO分子的结构式 。
 (2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。
(2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。
(3)右图是铜的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是 。
(5)煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛,甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 ; 1mol甲醛分子中σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西大学附中高三2月月考(理综)化学部分 题型:选择题
发展煤的液化技术被纳入 “十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目近日已获批复。已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇,从而实现液化。
(1)根据等电子原理,写出CO分子的结构式 。
 (2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。
(2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。
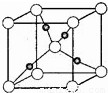
(3)右图是铜的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是 。
(5)煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛, 甲醇的沸点比甲醛的高,其主要原因是
;甲醛分子中碳原子轨道的杂化类型为
; 1mol甲醛分子中σ键的数目为 。
甲醇的沸点比甲醛的高,其主要原因是
;甲醛分子中碳原子轨道的杂化类型为
; 1mol甲醛分子中σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源:2011年山西大学附中高考化学一模试卷(2月份)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com