
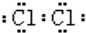 ,故答案为:
,故答案为: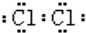 ;
;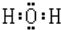 ,故答案为:
,故答案为: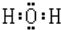 ;
; ,故答案为:
,故答案为: ;
; ,
, ;
; ,故答案为:
,故答案为: ;
; ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| 操作 | 现象 |
| 向盛有0.2g Na2O2的烧杯中加入50mL蒸馏水 | 剧列反应,产生能使带火星木条复燃的气体,得到的溶液a能产生丁达尔效应 |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
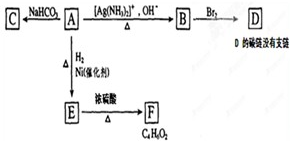
查看答案和解析>>
科目:高中化学 来源: 题型:
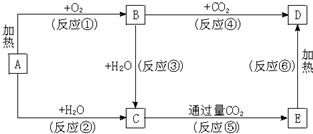
查看答案和解析>>
科目:高中化学 来源: 题型:
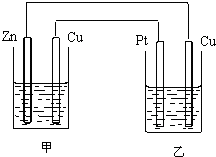 有如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.
有如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
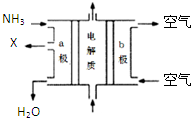 工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.
工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.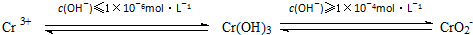
| c(OH-) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业生产中,合成氨采用压强越高,温度越低,越有利于提高经济效益 |
| B、增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 |
| C、采用催化剂时,反应的活化能降低,使反应易达过渡态,故明显加快 |
| D、增大催化剂的表面积,能增大氨气的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、消毒液与洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+═Cl2↑+H2O | ||||
B、用惰性电极电解AlCl3溶液会产生白色沉淀:2Al3++6Cl-+6H2O
| ||||
| C、在重铬酸钾溶液中滴入NaOH溶液,溶液变为黄色:Cr2O72-+2OH-═2CrO42-+H2O | ||||
| D、草酸使得酸性高锰酸钾溶液褪色:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com