
元素性质呈周期性变化的原因是 ( )
A.相对原子质量逐渐增大 B.核外电子排布呈周期性变化
C.元素的化合价呈周期性变化 D.核电荷数逐渐增大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
X、Y、Z、M和N均为短周期元素,X、Y、Z原子序数依次增大且最外层电子数之和为15,X与Z可形成XZ、XZ2型分子, Y与M气态化合物标准状况下密度约0.76g/L。N的原子半径为短周期元素中最大。回答下列问题:
(1)M、Z和N的元素符号分别为 、 、 。
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序为 。
(3)由上述元素组成、既含有共价键又含有离子键的化合物,其中含有极性共价键或含有非极性共价键,各举一例用电子式表示为 、 。
(4)X和Y组成的离子XY-对环境有害,可在NaClO的碱性溶液中转化为碳酸盐和氮气,相应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
构成物质的微粒种类及相互间的作用力是决定物质表现出何种物理性质的主要因素。
(1)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体中存在的微粒间作用力有_____________________________________________________________。
(2)氢键作用常表示为“A—H…B”,其中A、B为电负性很强的一类原子,如_____________________________________________________(列举三种)。
X、Y两种物质的分子结构和部分物理性质如下表,两者物理性质有差异的主要原因是_________________________________________________________________________________________________________________________________。
| 代号 | 结构简式 | 水中溶解 度/g(25 ℃) | 熔点/ ℃ | 沸点/ ℃ |
| X |
| 0.2 | 45 | 100 |
| Y |
| 1.7 | 114 | 295 |
(3)钙是人体所需的重要元素之一,有一种补钙剂——抗坏血酸钙的组成为Ca(C6H7O6)2·4H2O,其结构示意图如下:
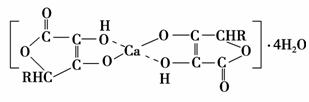
该物质中存在的化学键类型包括________(填字母)。
A.极性共价键 B.离子键
C.非极性共价键 D.配位键
(4)①CH2===CH2、②CH≡CH、③ 、④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是________。这四种分子中碳原子采取sp2杂化的是________(填序号)。
、④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是________。这四种分子中碳原子采取sp2杂化的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素最高化合价为+3
②第VIIA族元素是同周期中非金属性最强的元素
③第二周期第IVA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期第 IIA族
IIA族
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E 5种元素,已知:
①A原子最外层电子数是次外层电子数的2倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同。E原子M层上的电子比K层多5个。
②常温下B2是气体,它对氢气的相对密度是16。
③C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出淡紫色火焰,生成有刺激性气味的气体DB2。DB2中D的质量分数为50%。根据以上情况回答:
(1)A是______、B是______、C是______、D是______、E是______(写元素符号)。
(2)E的原子结构示意图__________,C的 离子结构示意图__________。
离子结构示意图__________。
(3)F和AB2反应的化学方程式 ___________________________________________。
___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是一种清洁能源。
(1)已知 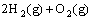 =2H2O(g) △H=- 483.6 kJ/mol
=2H2O(g) △H=- 483.6 kJ/mol
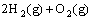 =2H2O(l) △H=-571.6 kJ/mol
=2H2O(l) △H=-571.6 kJ/mol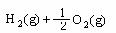
=H2O(l) △H=-285.8 kJ/mol
氢气的燃烧热是 kJ/mol
(2)人们可以通过多种途径获取氢气。
①1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为
②工业上制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g),已知在25℃时:
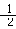 H2 (g) + O2 (g) = H2O(g) △H=-242 kJ/mol
H2 (g) + O2 (g) = H2O(g) △H=-242 kJ/mol
C(石墨)+O2(g)== CO2(g) △H=-394 kJ/mol
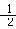 C(石墨)+ O2(g)== CO(g) △H=-111 kJ/mol
C(石墨)+ O2(g)== CO(g) △H=-111 kJ/mol
则25℃时一氧化碳与水蒸气作用转化成氢气和二氧化碳反应的△H= kJ/mol 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com