
【题目】在密闭容器里,发生反应2A(g)+B(g)![]() 2C(g)。下列条件不能说明该反应达到平衡的是
2C(g)。下列条件不能说明该反应达到平衡的是
A.2υ正(B)=υ逆(C)
B.该体系的密度不随时间而变化
C.该体系的温度不随时间而变化
D.1molA的化学键断裂,同时1molC的化学键也断裂
【答案】B
【解析】
A.2v正(B)=v逆(C)=2v逆(B),B的正、逆反应速率相等,该反应达到平衡状态,故A不选;
B.该反应前后混合气体的质量不变、容器的体积不变,气体的密度始终不变,所以该体系的密度不随时间变化时,该反应不一定达到平衡状态,故B选;
C.该反应的正反应无论是吸热反应还是放热反应,随着反应的进行反应体系温度一定改变,当该体系的温度不随时间而变化时,说明正、逆反应速率相等,反应达到平衡状态,故C不选;
D.1 molA的化学键断裂,反应正向进行,同时1molC的化学键也断裂,反应逆向进行,同时生成1molA,A的正、逆反应速率相等,该反应达到平衡状态,故D不选;
故选B。


科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为___,盐桥中K+移向___(填“装置B”或“装置C”)。
(2)装置A中总反应的离子方程式为___。
(3)若装置E中的目的是在Cu材料上镀银,则X为___,极板N的材料为___。
(4)装置D中右侧石墨电极反应式为:___;
(5)某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如图所示,当该装置工作时,按要求填空:
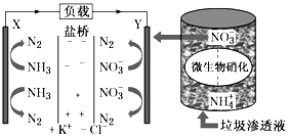
①电流由极___(填“X→Y”或“Y→X”),当电路中流过7.5mol电子时,共产生标准状况下N2的体积为___;
②Y极发生的反应为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的反应:Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
A.Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B.反应过程正极电极反应式为2H+-2e-=H2↑
C.若将该反应设计成原电池,则Zn为负极
D.若设计成原电池,当有65 g锌溶解时,理论上正极放出22.4 L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题。
(1)羟基的电子式__________ ,(CH3)3COH的名称__________(系统命名法)
(2)从下列物质中选择对应类型的物质的序号填空。
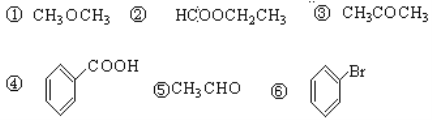
酸:_________ 酯:_________ 醚:_________ 酮:_________
(3)下列各组物质:
① O2和O3 ②乙醇和甲醚;③ 淀粉和纤维素;④ 苯和甲苯;⑤ 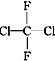 和
和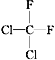 ;⑥
;⑥ ![]() 和
和![]() ;⑦ CH3CH2NO2和
;⑦ CH3CH2NO2和![]()
A.互为同系物的是___________, B.互为同分异构体的是__________,C.属于同一种物质的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.盐酸滴入氨水中:H++OH-=H2O
B.碳酸氢根离子的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C.以石墨作电极电解氯化钾溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.硫酸铅蓄电池的正极反应为:PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某同学探究Na2SO3溶液和铬(VI)盐溶液反应规律的实验记录,已知:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+
2CrO42-(黄色)+ 2H+
序号 | a | b | 现象 | |
| 1 | 2 mL 0.05 mol·L1 K2Cr2O7溶液(pH = 2) | 3滴饱和Na2SO3溶液(pH = 9) | 溶液变绿色(含Cr3+) |
2 | 2 mL 0.1 mol·L1 K2CrO4溶液(pH = 8) | 3滴饱和Na2SO3溶液 | 溶液没有明显变化 | |
3 | 2 mL饱和Na2SO3溶液 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变黄色 | |
4 | 2 mL蒸馏水 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变成浅橙色 |
下列说法不正确的是
A. 实验1中的绿色溶液中含有SO42-
B. 实验1、2的a溶液中所含的离子种类相同
C. 向实验3溶液中继续滴加过量硫酸可使溶液变为浅橙色
D. 实验4的目的是排除稀释对溶液颜色变化造成的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列各小题。
(1)由铜片、锌片和1L0.5mol/L的H2SO4(足量)组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体。请回答:
①负极是___(填“锌”或“铜”),发生___反应(填“氧化”或“还原”)。

②假设反应后溶液体积不变,反应后溶液的pH为___(用对数表示)。
(2)如图是某燃料电池的示意图,请回答:
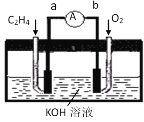
①在导线中电子流动方向为___(用a、b表示)。
②该燃料电池的负极反应式为___。
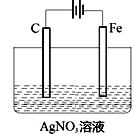
(3)如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。
①Fe电极叫做___极,C电极的反应式为___。
②当某电极的固体质量增重21.6g时,整个装置共产生气体(标准状况下)体积2.24L,推断该气体的组成___(包括成分和体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B.乙苯能发生氧化反应,但不能发生还原反应
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.苯乙烯在合适条件下催化加氢可生成乙基环己烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com