
已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,它们之间的相互转化关系如下图所示(部分产物及反应条件没有列出):
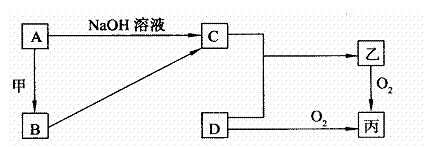
(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为 ;B在潮湿的空气中易发生电化学腐蚀,写出其发生电化学腐蚀时原电池负极的电极反应式: 。
(2)若乙在水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式 ;已知16g固体单质D完全燃烧转化成乙时,放出148.4kJ的热量,则该反应的热化学方程式为 。
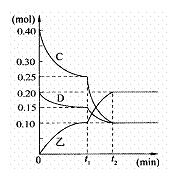
(3)若乙在水溶液呈弱碱性,并可用作农业化肥,D常况下为气体,则进行下列研究: 现将0.40 mol C和0.20 mol D充入10L的密闭容器中,在一定条件下使其发生反应,有关C、D、乙三者的物质的量的变化与时间的关系如右图所示:
①若t1 = 10min,则0至t1时间内C物质的平均反应速率为 ;该反应在t2时达到平衡,其化学反应方程式为 ,此温度下的该反应的平衡常数为 。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是 (填下列各项序号)
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| b-a-4c |
| 2 |
| b-a-4c |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
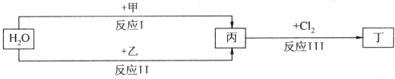
 (2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,
(2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧一定要用火去点燃 | B、已知镓元素位于周期表中第4周期第ⅢA族,根据镓酸的酸性比偏铝酸强,所以镓的金属性比铝弱 | C、2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界.这一完美结合现实与理论的化学系统模型,为更全面了解并预测化学反应进程奠定了基础 | D、化肥的使用有效地提高了农作物的产量,常见的氮肥可分为铵态氮肥和硝态氮肥,硝酸盐和尿素都属于硝态氮肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
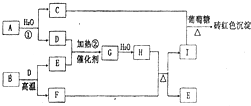
(08浙江金丽衢十二校联考)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题: 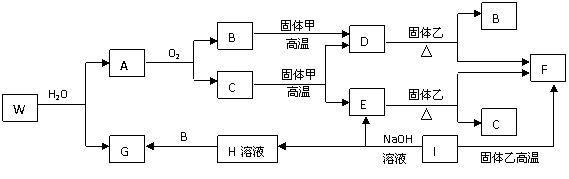
(1)B的电子式为 ,固体乙的化学式可能是 ;
(2)上述转化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中属于置换反应的是(填序号) ;
(3)写出W和水反应的化学方程式____________________________________________,
I和NaOH溶液反应的离子方程式________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com