
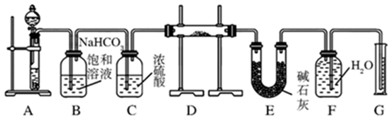
分析 先在装置F中进入适量水,关闭A中分液漏斗的阀门,对装置A中的试管加热,根据F中长导管液面变化判断装置的气密性,装置A是碳酸钙和盐酸反应生成二氧化碳,通过饱和碳酸氢钠溶液吸收二氧化碳中的氯化氢气体,通过C中浓硫酸吸收水蒸气干燥气体,通过装置D,二氧化碳和过氧化钠、氧化钠反应,生成的气体氧气通过E干燥后用FG排液量气测定气体氧气的体积,来计算样品中过氧化钠的纯度,
(1)根据实验原理装置A采用的是碳酸钙和盐酸反应生成二氧化碳,根据碳酸钙和硫酸反应的情况来回答;
(2)B中饱和的碳酸氢钠溶液可以吸收HCl,但是不吸收二氧化碳;
(3)E中碱石灰可以吸收二氧化碳;
(4)根据氧化钠和过氧化钠的性质来回答,过氧化钠和氧化钠都和二氧化碳发生反应;
(5)应在常温下读数,且保持液面水平相切;
(6)根据氧气的量和过氧化钠量的关系来获得过氧化钠质量,进而计算过氧化钠的纯度.
解答 解:(1)装置A是碳酸钙和盐酸反应生成二氧化碳,碳酸钙和硫酸反应时,生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续,所以用盐酸而不用硫酸来反应,
故答案为:6mol/L盐酸;A的目的是制取CO2,硫酸与CaCO3固体反应生成CaSO4微溶于水,会覆盖在CaCO3固体表面,使反应不能持续;
(2)B中饱和的碳酸氢钠溶液可以吸收HCl,但是不吸收二氧化碳,碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去;浓硫酸具有吸水性,可以将二氧化碳干燥,B中反应的离子方程式为:HCO3-+H+=H2O+CO2↑,
故答案为:除去气体中的HCl;HCO3-+H+=H2O+CO2↑;
(3)装置E中碱石灰的作用是吸收二氧化碳,防止水蒸气进入D中,防止对氧气的体积测量造成干扰;
故答案为:吸收装置D中反应剩余的CO2、防止水蒸气进入D中;
(4)装置D中氧化钠和过氧化钠和二氧化碳反应的原理方程式分别为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3,
故答案为:2Na2O2+2CO2=2Na2CO3+O2、Na2O+CO2=Na2CO3;
(5)实验结束时,为保证结果的可靠性,在测量筒中水的体积时,为减小实验误差,可待气体温度恢复到常温,上下移动量筒,使量筒中液面和广口瓶中液面相平,读数时平时量筒,使视线与量筒中液面凹液面最低处保持水平,
故答案为:待气体温度恢复到常温;上下移动量筒,使量筒中液面和广口瓶中液面相平或读数时平时量筒;
(6)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量为$\frac{0.224L}{22.4L/mol}$=0.01mol,过氧化钠的物质的量为0.02mol,过氧化钠的纯度=$\frac{0.02mol×78g/mol}{2.0g}$×100%=78%,
故答案为:78%.
点评 本题考查学生过氧化钠的化学性质知识,通过实验方式考查增加了难度,综合性较强.注意硫酸钙的微溶性,主要从反应原理和装置特点分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 石油产品--直馏汽油和裂化汽油的成分相同 | |
| B. | 获得上述化石能源的过程均为化学变化 | |
| C. | 水煤气是通过煤的液化得到的气体燃料 | |
| D. | 天然气是一种清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸有脱水性,故可用做干燥剂 | |
| B. | 浓硫酸有强酸性,故能与金属活动顺序氢后的金属反应 | |
| C. | 硫酸的酸性比盐酸强,利用复分解反应用硫酸可以制盐酸 | |
| D. | 由于浓硫酸具强氧化性,因此不能干燥硫化氢和碘化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和乳酸(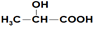 )的混合物共3.0 g,含有的原子总数为0.4 NA )的混合物共3.0 g,含有的原子总数为0.4 NA | |
| B. | 4.6 g乙醇含有-OH数为NA | |
| C. | 1.7 g H2O2中含有的电子数为NA | |
| D. | 1 mol Na2O2固体中含离子总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:X>Y>Z>R | |
| B. | 最高价氧化物的水化物的酸性:R>X | |
| C. | 氢化物的稳定性:X>Y | |
| D. | Y与Z形成的两种化合物中的化学键和晶体类型均相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com