
| 元素名称 | 氟 | 氯 | 溴 | 碘 | 砹 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
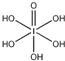 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6 离子各一个)
离子各一个) )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,故答案为:<;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,故答案为:<;| 7+1-2×2 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |
| 4 |
| NA |
| 1 |
| 4 |
| ||
| 2 |
| ||
| 2 |


科目:高中化学 来源: 题型:
 以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O
以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O| 通电 |
| A、在阴极室,随着反应的进行溶液的pH逐渐变小 |
| B、不锈钢电极上生成O2,惰性电极上得到H2 |
| C、惰性电极发生的电极反应为2H2O-4e-═4H++O2↑ |
| D、不锈钢应连接直流电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C02、CS2、SO2都是直线型的分子 |
| B、COCl2、SF6、CO32-都是平面三角型的分子 |
| C、BF3分子的键角大于CH4分子的键角 |
| D、PCl3、NH3、BCl3都是三角锥形的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓H2SO4 |
| △ |
| A、4种 | B、5种 | C、6种 | D、7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥ | B、②③⑥ |
| C、②⑤⑥ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于15% | B、大于15% |
| C、小于15% | D、无法估计 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶质的质量分数为ω=
| ||
| B、用水稀释该溶液,OH- 的物质的量增加 | ||
| C、该溶液中共有6种微粒 | ||
| D、上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 NaCl与0.05 mol?L-1 Na2CO3溶液中的Na+数目 |
| B、质量相等的金刚石与C60中的碳原子数目 |
| C、标准状况下,等体积的SO2与SO3的分子数目 |
| D、28 g乙烯气体和56g环丁烷(C4H8)气体中含有的碳原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是
I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com