
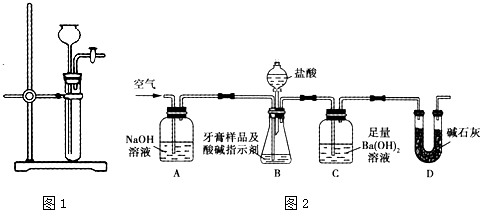


科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
| 11m-3b |
| 11m |
| 11m-3b |
| 11m |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
| 14 |
| 5 |
| 14 |
| 5 |
| n(Ca) |
| n(N) |
| 3 |
| 2 |
| n(Ca) |
| n(N) |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||

| 41n |
| 17m |
| 41n |
| 17m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 11m-3b |
| 11m |
| 11m-3b |
| 11m |
m-
| ||
| m |
m-
| ||
| m |
 (5)经过大家的讨论,决定采用下图装置(干燥管中试剂为无水氯化钙,锥形瓶中为mg铁炭合金和足量稀硫酸.)和其他常用实验仪器测定某些数据即可.为了快速测算出铁的质量分数,最简便的实验操作是
(5)经过大家的讨论,决定采用下图装置(干燥管中试剂为无水氯化钙,锥形瓶中为mg铁炭合金和足量稀硫酸.)和其他常用实验仪器测定某些数据即可.为了快速测算出铁的质量分数,最简便的实验操作是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
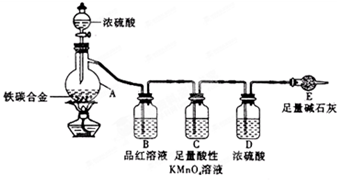 某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.| △ |
| ||
| ||
| 3b |
| 11a |
| 3b |
| 11a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com