
【题目】氰(CN)2,硫氰(SCN)2等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为: Cl-<Br-<CN-<SCN-<I-,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是
A.4HCN(浓)+MnO2![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
B.(CN)2+H2O=2H++CN-+CNO-
C.(CN)2+2OH-=CN-+CNO-+H2O
D.(CN)2+2SCN-=2CN-+(SCN)2
【答案】B
【解析】
阴离子的还原性顺序为:Cl-<Br-<CN-<SCN-<I-,所以分子的氧化性为:Cl2 >Br2>(CN)2 >(SCN)2>I2,结合以上规律,根据卤素单质的性质进行分析。
A.MnO2能与浓盐酸反应制得氯气,说明二氧化锰的氧化性大于氯气,氯气的氧化性大于(CN)2,则反应4HCN(浓)+MnO2![]() Mn(CN)2+(CN)2↑+2H2O能进行,故A正确;
Mn(CN)2+(CN)2↑+2H2O能进行,故A正确;
B.卤素单质能与水反应,(CN)2与卤素单质的性质相似,则与水反应,发生(CN)2+H2O![]() HCN+HCNO,拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,所以在溶液中主要以分子形式存在,不能拆成离子,故B错误;
HCN+HCNO,拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,所以在溶液中主要以分子形式存在,不能拆成离子,故B错误;
C.(CN)2与卤素单质的性质相似,可以发生类似氯气与碱的反应,与碱发生反应(CN)2+2OH-=CN-+CNO-+H2O,故C正确;
D.还原性:CN-<SCN-,则(CN)2能氧化SCN-,即2SCN-+(CN)2=(SCN)2+2CN-,故D正确;
答案为B。
【点晴】
需要学生对信息应用进行利用,注意把握题中信息,“(CN)2、(SCN)2与卤素单质的性质相似”,可知拟卤素能与水、碱反应;拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,则在溶液中主要以分子形式存在,结合阴离子的还原性强弱顺序分析。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】下列关于胶体的说法正确的是( )
A. 依据丁达尔效应可将分散系分为溶液、胶体与浊液
B. 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C. Na+、K+、SO42-、Br-能在Fe(OH)3胶体中大量共存
D. 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的说法正确的是( )
A. 新制氯水含有Cl2、HCl、HClO、H2O分子
B. 紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色
C. 氯水和液氯都能使干燥的有色布条褪色
D. 新制氯水的pH值要比久置氯水的pH值小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验发现,298 K时,在氯化铁酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是
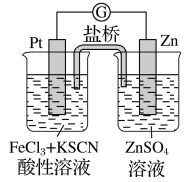
A. 该原电池的正极反应是:Zn-2e-=Zn2+
B. 左烧杯中溶液的红色逐渐褪去
C. 该电池铂电极上立即有气泡出现
D. 该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2其原理如图所示,正确的是( )
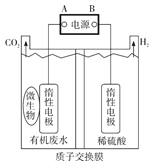
A. 通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小
B. 电源A极为负极
C. 通电后,若有22.4LH2生成,则转移2mol电子
D. 与电源A极相连的惰性电极上发生的反应为CH3COOH-8e-+2H2O=2CO2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2的转化再利用能够很好的减少温室效应,给环境问题的解决提供了一个很好的方法。其中用有机合成的方式可以合成醋酸、甲醇等,用无机方式转化为碳酸盐或者碳酸氢盐。
I.(1)土壤中也含有碳酸盐,土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:_______________。加入石膏(CaSO4·5H2O)可以使土壤碱性降低,原因是(用化学用语表达)_____________________________。
(2)常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入40mL0.1mol/LHCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:
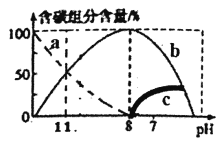
①在同一溶液中,H2CO3、HCO3-、CO32-_____(填“能”或“不能”)大量共存。
②溶液中各种粒子的物质的量浓度关系正确的是为_______。
A.pH=11时:c(Na+)>c(H2CO3)>c(CO32-)>c(OH-)>c(H+)
B.pH=11时:c(HCO3-)>c(Cl-)
C.pH=7时: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)=c(H+)
D.pH=11时: c(Na+)+c(H+)=3c(CO32-)+c(OH-)
③计算出碳酸钠的水解平衡常数为________。
II.醋酸成本低,在生产中被广泛应用。
(1)若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H=-46.8kJ/mol,则H2SO4(aq)与NaOH(aq)的中和热为57.3kJ/mol,则CH3COOH在水溶液中电离的△H=_________。
(2)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势.其合成的基本反应如下: CH2=CH2(g)+CH3COOH(l) ![]() CH3COOC2H5(l) 该反应类型是______,为提高乙酸乙酯的合成速率和产率,可以采取的措施有________(任写出一条)。
CH3COOC2H5(l) 该反应类型是______,为提高乙酸乙酯的合成速率和产率,可以采取的措施有________(任写出一条)。
(3)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在保持不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。

回答下列问题:
①温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是______[用v(P1).v(P2)、v(P3)分别表示不同压强下的反应速率];
②a、b、c三点乙烯的转化率从大到小顺序______。
③P1下乙酸乙酯的产率60℃~90℃时,先升高后降低的原因是_______,根据测定实验结果分析,较适宜的生产条件是___________(合适的压强和温度)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是国际上公认的对环境无二次污染的消毒杀菌剂。它常温下为气体,易溶于水,受热易分解。甲醇法制制备二氧化氯的工艺如图:
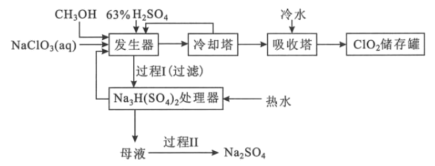
回答下列问题:
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有___性。
(2)加入“发生器”的浓硫酸先稀释为63%H2SO4,冷却后加入反应器的原因是___。实际操作中再“发生器”中加入适量NaCl以加快反应速率,若NaCl过量会发生成污染环境的一种气体的分子式为___。
(3)若1molCH3OH反应时转移6mole-,则“发生器”中发生反应的主要化学方程式为___。
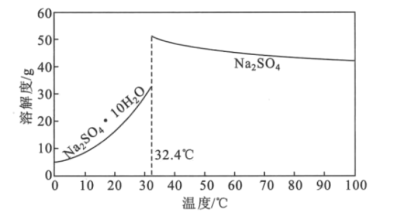
(4)Na2SO4·10H2O和Na2SO4的溶解度曲线如图所示,则“过程Ⅱ”的操作是:加热浓缩至有大量晶体析出、___、经干燥得Na2SO4固体。
(5)采用惰性电极为阳极,通过电解亚氯酸钠溶液的方法也可以制备二氧化氯,其阳极的电极反应式为___。
(6)与甲醇法制备二氧化氯相比,电解法的优点是___(写出2点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
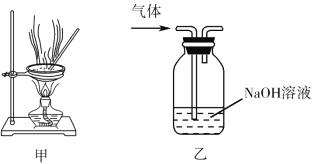
【题目】下列实验操作能达到实验目的的是
A. 用经水湿润的pH试纸测量溶液的pH
B. 将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L1NaOH溶液
C. 用装置甲蒸干AlCl3溶液制无水AlCl3固体
D. 用装置乙除去实验室所制乙烯中的少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO410H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com