
体积一定的绝热密闭容器中加入等物质的量的X、Y,进行如下可逆反应:
X(g)+Y(g) Z(g)+W(s)ΔH>0下列叙述正确的是( )
Z(g)+W(s)ΔH>0下列叙述正确的是( )
A.若继续充入X,平衡向正反应方向移动,Y的转化率增大
B.若继续充入Z,平衡逆向移动,Z的体积分数减小
C.若移走部分W,平衡正向移动
D.平衡后移走X,上述反应的ΔH减小
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=== +NO↑+H2O
+NO↑+H2O
B.碳酸氢钠溶液与过量的澄清石灰水反应: +Ca2++2OH-===CaCO3↓+
+Ca2++2OH-===CaCO3↓+ +2H2O
+2H2O
C.浓盐酸酸化的KMnO4溶液与H2O2反应: +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++ +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属及其化合物的说法中正确的是
A.铝和氢氧化钠溶液反应生成Al(OH)3和H2O
B.钠在空气中燃烧生成淡黄色的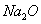
C.铁在高温下与水蒸气反应生成Fe2O3和H2
D.用碳酸钠和氢氧化钙反应制NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g)
CH3OH(g)
反应II: CO2(g) + 3H2(g) CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g)
上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
则CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=
(3)某实验小组依据甲醇燃烧的反应原理,设计如下左图所示的电池装置。
①该电池负极的电极反应为 。
②工作一段时间后,测得溶液的pH (填增大、不变、减小)。
③用该电池作电源,组成如下右图所示装置(a、b、c、d均为石墨电极),甲容器装250mL0.04mol/LCuSO4溶液,乙容器装300mL饱和NaCl溶液,写出c电极的电极反应 ,常温下,当300mL乙溶液的pH为13时,断开电源,则在甲醇电池中消耗O2的体积为 mL(标准状况) ,电解后向甲中加入适量下列某一种物质 ,可以使溶液恢复到原来状态,该物质是 (填写编号) 。
A.CuO B.CuCO3 C.Cu(OH)2 D.Cu2(OH)2CO3

查看答案和解析>>
科目:高中化学 来源: 题型:
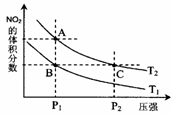
反应N2O4(g) 2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0. 10 mol/L NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3=Na++ H++ CO32-
B.25℃时,加水稀释后,n(H+)与n( OH-)的乘积变大
C.离子浓度关系:c( Na+)+c(H+)=c( OH-)+c( HCO3- )+c( CO32-)
D.温度升高,c(HCO3-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
将Mg、Cu组成的混合物26.4 g,投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96 L,向反应后的溶液中加入过量的5mol/L的NaOH溶液300 mL,金属离子完全沉淀。则形成沉淀的质量是:( )
A.32.8g B.46.8g C.53.6g D.63.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下叙述错误的是
A.NO2由反应N2+2O2 2NO2生成
2NO2生成
B.总反应可表示为2SO2+O2+2H2O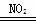 2H2SO4
2H2SO4
C.还可能发生的反应有4NO2+O2+2H2O=4HNO3
D.还可能发生的反应有4NO+3O2+2H2O=4HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com