
 取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol.L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,下列有关说法正确的是( )
取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol.L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,下列有关说法正确的是( )| A、原溶液中NaOH的物质的量为0.75mol |
| B、通入CO2后所得的溶液溶质成分为NaOH和Na2CO3 |
| C、通入CO2后所得的溶液中含有2.5×10-3mol NaHCO3 |
| D、纵坐标中a的数值为224 |
| 1 |
| 2 |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、用量筒量取8.2mL某溶液时俯视读数 |
| B、中和滴定用的锥形瓶加人待测液后,再加少量蒸馏水稀释 |
| C、测定一包白色粉末的质量.将药品放在右盘,砝码放在左盘,并移动游码使之平衡 |
| D、配制0.1 mol/L的NaOH溶液100mL,未经冷却即注入容量瓶定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答:
取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol/LCH3COONa溶液,c(OH-)=c(CH3COOH)+c(H+) |
| B、向0.1 mol/L氨水中加入少量硫酸铵固体,溶液pH减小 |
| C、氯水中滴加烧碱溶液,当c(Cl-)+c(ClO-)=c(Na+)时,溶液一定是呈中性 |
| D、某温度下将稀氨水滴加到稀盐酸中,当溶液的pH=7时,一定有c(Cl-)=c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
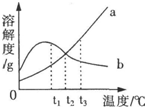 有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )
有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )| A、a物质的溶解度随着温度的升高而增大 |
| B、在t2℃时,a、b两种物质的溶液中溶质的质量分数一定相等 |
| C、t3℃时,a物质的溶解度大于b物质的溶解度 |
| D、将a、b两种物质的饱和溶液从t3℃降温至t1℃,a有晶体析出,b无晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在AlCl3溶液中:K+、Na+、SiO32-、SO42- | ||
| B、能使甲基橙变红的溶液:Na+、NH4+、Fe2+、NO3- | ||
| C、在水电离出的氢离子浓度为1×10-14mol/L的溶液中:Ca2+、HCO3-、Cl-、Na+ | ||
D、在
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com