
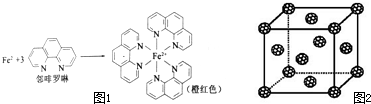
分析 (1)①铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,根据构造原理写出亚铁离子核外电子排布式;
②根据价层电子对互斥理论确定羟胺NH2OH中存在sp3杂化的原子;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数;
(2)Cu2+提供空轨道,N原子提供孤对电子,形成配位键,N、H原子之间以共价键结合,內界离子与外界离子以离子键结合;
(3)根据电负性的角度分析;
(4)Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,属于分子晶体;
(5)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,如图所示: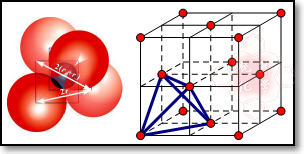 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6×$\frac{1}{2}$=4个C60分子,然后求出化学式.
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6×$\frac{1}{2}$=4个C60分子,然后求出化学式.
解答 解:(1)①铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为ls22s22p63s23p63d6或[Ar]3d6,
故答案为:ls22s22p63s23p63d6或[Ar]3d6;
②羟胺分子中,价层电子对为4的原子有N、O原子,所以采用sp3杂化的原子有N、O原子,故答案为:N、O;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数,所以Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为6,故答案为:6;
(2)Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,NH3分子中N、H原子之间以共价键结合,內界离子[Cu(NH3)4]2+与外界离子SO42-以离子键结合,
故答案为:离子键、共价键、配位键;
(3)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,
故答案为:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,NF3不易与Cu2+形成配离子;
(4)Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于分子晶体,故答案为:分子;
(5)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,如图所示: 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×$\frac{1}{2}$=4个C60分子,故组成 K8(C60)4,化学式为K2C60,故答案为:K2C60.
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×$\frac{1}{2}$=4个C60分子,故组成 K8(C60)4,化学式为K2C60,故答案为:K2C60.
点评 本题目综合性较大,涉及晶体、化学键、杂化轨道、电负性、晶胞计算等,晶胞计算难度较大,为易错点.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH值可能是5 | B. | 此溶液不存在 | ||
| C. | 该溶液的pH值一定是9 | D. | 该溶液的pH值可能是7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NaNO2溶液中滴加酸性KMnO4溶液:5NO2-+2MnO4-+3H2O═5NO3-+2Mn2++6OH- | |
| C. | 醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3固体 | B. | 水 | C. | 硫酸钾固体 | D. | NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种元素的原子序数依次增大,A的最高价和最低价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道是4s电子数的4倍.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大,A的最高价和最低价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道是4s电子数的4倍.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷的外围电子排布式:3d104S24p3 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: | |
| D. | 过氧化钠的电子式: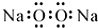 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com