
【题目】实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O
回答如下问题:
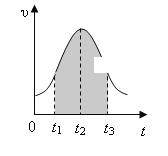
(1)0→t2时间段内反应速率增大的原因是: _________________________________ ,
(2)t2→t时间段内反应速率减小的原因是: _______________ ,
(3)图中阴影部分“面积”表示t1→t3时间里________ 。
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
【答案】0→t2:因放热反应进行而使溶液的温度升高,反应速率增大 t2→t 随着反应的进行反应物的消耗,浓度降低,反应速率减小 A、D
【解析】
(1)根据温度对化学反应速率的影响判断;
(2)根据浓度对化学反应速率的影响判断;
(3)根据v=c/t,推导得v×t=c判断。
(1)该反应是放热反应,温度越高,反应速率越快,所以温度是改变反应速率的主要原因;
因此,本题正确答案是: 0→t2:因放热反应进行而使溶液的温度升高,反应速率增大。
(2)随着反应的进行,反应物的浓度降低,浓度越低,反应速率越小,所以浓度的改变是反应速率变化的主要原因;
因此,本题正确答案是: t2→t 随着反应的进行反应物的消耗,浓度降低,反应速率减小。
(3)根据v=c/t,推导得v×t=c,所以阴影面积表示反应物浓度的减少或生成物浓度的增加;所以AD选项是正确的;
综上所述,本题答案是: A、D。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】H2R是一种二元弱酸。25℃时,向H2R溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为![]() 或
或![]() ]与pH的变化关系如图所示。下列说法一定正确的是
]与pH的变化关系如图所示。下列说法一定正确的是
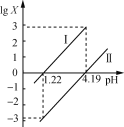
A. Ⅱ表示lg![]() 与pH的变化关系
与pH的变化关系
B. pH=1.22的溶液中:2c(R2-)+c(HR-)<c(Na+)
C. NaHR溶液中c(H+)>c(OH-)
D. 当溶液呈中性时:c(Na+)>c(HR-)>c(R2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的NO与CO发生如下反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH<0,下列说法中错误的是
N2(g)+2CO2(g) ΔH<0,下列说法中错误的是
A. 该反应中反应物的总能量高于生成物的总能量
B. 升高温度,正反应速率加快,逆反应速率减慢
C. 升高温度,NO转化率减小
D. 使用合适的催化剂,能增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下部分弱酸的电离常数如表。下列有关说法不正确的是
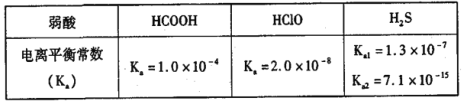
A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c( HCOOH)/c(HCOO-)=10
B. 相同pH的 HCOONa和NaClO溶液中离子总浓度前者大
C. 等浓度等体积的Na2S和 HCOOH混合后:c(Na+)=2c(HCOO-)+2c( HCOOH)
D. 向NaClO溶液中通入H2S发生的反应为ClO-+H2S![]() HS-+HClO
HS-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据周期表中元素原子结构性质回答下列问题:
(1)C原子价层电子的轨道表达式为___________,基态As原子中,核外电子占据的最高能级的电子云轮廓图为___________形。
(2)已知等电子体具有相似的结构和化学键特征,O22+与元素N的单质互为等电子体,则O22+的电子式为___________。
(3)NH3能与众多过渡元素离子形成配合物,向CuSO4溶液中加入过量氨水,得到深蓝色溶液,向其中加人乙醇析出深蓝色晶体,加入乙醇的作用___________,该晶体的化学式为___________。
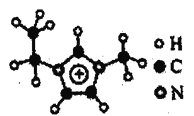
(4)如图EMIM+离子中,碳原子的杂化轨道类型为___________。分子中的大π键可用符号πnm表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则EMM+离子中的大π键应表示为___________。
(5)NiO晶体结构与NaCl相似,晶胞中Ni2+位置在顶点和面心,则晶胞中O2-位置在___________,已知晶体密度为dg/cm3,N2+原子半径为xpm,O2-原子半径为ypm阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为___________(列出化简后的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相 中经自由基偶联反应生成乙烯,其反应如下:2CH4(g) ![]() C2H4(g) +2H2(g) ΔH>0
C2H4(g) +2H2(g) ΔH>0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=_____________ (用含a.b.c.d的代数式表示)。
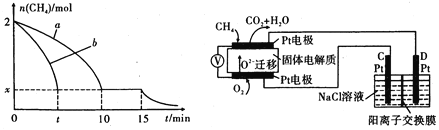
(1)T1温度时,向1 L的恒容反应器中充入2 molCH4 ,仅发生上述反应,反应过程中 0~15 min CH4的物质的量随时间变化如图,测得10-15 min时H2的浓度为1.6 mol/L。
①0~ 10 min内CH4表示的反应速率为____mol/(Lmin) o
②若图中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂 时,达到平衡过程中n (CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填"a"或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4).c2(H2) 其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正 ____V逆(选填“〉”、“=”或“<”),判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-
①C极的Pt为_______ 极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________ 。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则阴极区所得溶液在25 0C时pH=_______ (假设电解前后NaCl溶液的体积均为500 mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
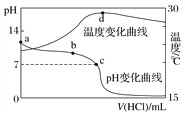
A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH![]() )
)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题:
(1)Fe原子的核外电子排布式为_____。
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第一电离能I1(Fe)____(填“大于”或“小于”)I1(Mn),原因是___。
(3)FeF3具有较高的熔点(熔点高于1000℃),其化学键类型是__,FeBr3的式量大于FeF3,但其熔点只有200℃,原因是____。
(4)FeCl3可与KSCN、苯酚溶液发生显色反应。
①SCN-的三种元素中电负性最大的是____。
②苯酚(![]() )分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
)分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
(5)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____(列出计算式)g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)用_______式滴定管盛装c mol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是____________ 如图表示某次滴定时50 mL滴定管中前后液面的位置。滴定管读数时应注意____________________________________。尖嘴部分应____________________________。用去的标准盐酸的体积是_____________mL

(2)该实验应选用_____作指示剂;操作中如何确定终点?______________________________。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果__________;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com