
分析 (1)(2)该反应的△G=△H-T•△S=178.3KJ•mol-1-298.15K×0.1604KJ•mol-1=130.5KJ•mol-1.△G>0;
(3)化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T•△S<0时,依据题干给出焓变及熵变计算△H-T•△S数值,据此判断反应能自发进行;
(4)反应能自发进行,应满则△G=△H-T•△S<0,以此解答该题.
解答 解:(1)该反应的△G=△H-T•△S=178.3KJ•mol-1-298.15K×0.1604KJ•mol-1=130.5KJ•mol-1.△G>0,所以不能自发,故答案为:不能;
(2)该反应的△G=△H-T•△S=178.3KJ•mol-1-298.15K×0.1604KJ•mol-1=130.5KJ•mol-1.△G>0,所以在100Kpa、298.15K 时,石灰石分解反应为非自发反应,但在高温的条件下能自发行进,故答案为:能;
(3)要想反应能自发进行则需△G=△H-T•△S<0,178.3KJ•mol-1-T×160.4KJ•mol-1=0,解得:T=1112K,故答案为:1112K;
(4)该反应在一定温度下能够自发的向右进行,这说明△H-T△S一定是小于0,根据方程式可知该反应的△S>0,所以如果△H<0,则该反应在任何温度下都是自发进行的,而该反应在一定温度下能够自发的向右进行,因此该反应的反应热△H>0,故选A.
点评 该题是基础性试题的考查,难度不大.该题的关键是掌握△G=△H-T•△S,并能灵活运用即可,有利于培养学生的逻辑思维能力.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:实验题
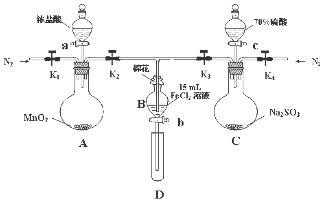 为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,现有浓度都为0.1mol•L-1HX、HY的溶液各20ml,分别用0.1mol•L-1NaOH溶液滴定.溶液的pH与加入NaOH溶液体积V的关系如图所示.
常温下,现有浓度都为0.1mol•L-1HX、HY的溶液各20ml,分别用0.1mol•L-1NaOH溶液滴定.溶液的pH与加入NaOH溶液体积V的关系如图所示.| A. | 滴定过程中,水电离的c(H+)•c(OH-)均不变 | |
| B. | HX的电离程度小于HY的电离程度 | |
| C. | V=10ml时,c(HX)+c(X-)=2c(Na+) | |
| D. | V=20ml时,c(Y-)>c(X-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
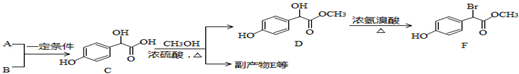
 ;
;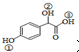 )中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②;
)中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②; .
.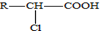 .A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOC2H5.
.A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOC2H5.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
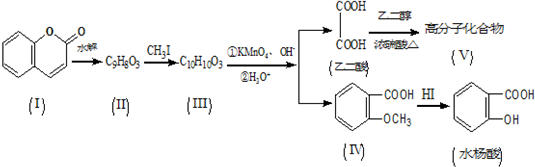
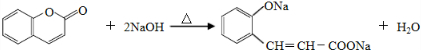 .
.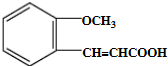 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水在化学反应中既可做氧化剂又可做还原剂 | |
| B. | 14C和14N质量数相同,化学性质也相同 | |
| C. | 牛奶是一种胶体,能发生丁达尔现象 | |
| D. | “水滴石穿”是因为CaCO3与CO2、水发生了化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2 | B. | K2SO4 | C. | P2O5 | D. | HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com