
����Ŀ�����ݻ��̶���VL�ܱ������г���4molNH3��5molO2���������·�Ӧ��4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)����ش��������⣺
4NO(g)+6H2O(g)����ش��������⣺
(1)������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����_______��
A ��������������������
B c(O2)����
C v(O2)��1.25v(NH3)
D ��ϵѹǿ����
E ��ͬʱ���ڣ�����0.1 mol NH3��ͬʱ������0.1 mol NO
(2)����Ӧ�ھ����ܱ�ϵͳ�н���ʱ�������������䣬��Ӧ��������������С������������������Ϊ______����������С��ԭ����_____��
(3)1mol NH3(g)�ڴ�������ȫȼ����������Ⱦ����̬���ʣ��ų�akJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ__________________________________________��
(4)����(3)������Ӧ���Ϊ�������ҺΪKOH��ԭ��أ�����Ӧʽ _________________________��
���𰸡�BDE ��ϵ�¶����� ��Ӧ��Ũ�ȼ�С 6NH3(g)+3O2(g)=3N2(g)+6H2O(g) ��H =��6a kJ��mol-1 2NH3-6e-+6OH- = N2+6H2O
��������
��1�����ݻ�ѧƽ��״̬���������桢���������䡢�����жϻ�ѧ��Ӧ�Ƿ�ﵽƽ�⣻����ѧ��Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��ٷ����仯���ɴ�������һЩ�����Բ��䣬�Դ˽����⣻
��2�����ݸ÷�ӦΪ���ȷ�Ӧ����Ӧ�������¶����ߣ��������±�ԭƽ���¶ȸ߽��з�����Ӧ���ʱ仯�����Ũ�ȱ仯��ΪӰ�췴Ӧ���ʵ���Ҫ���أ�
��3�������Ȼ�ѧ����ʽ����д������֪�����ʵ����ʵ����뷴Ӧ�ų������������ȣ������ڴ�������ȫȼ����������Ⱦ����̬����ӦΪ������ˮ��
��4��ԭ��صĸ�������������Ӧ�������ڸ�����Ӧ���ɵ�����
��1��A����Ӧǰ�������壬��������ʼ�ղ��䣬A�����
B��c ��O2�����䣬˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬��B����ȷ��
C��v��O2��=1.25v��NH3����û�и��������淴Ӧ���ʣ����ж��Ƿ�ﵽƽ��״̬��C�����
D���÷�Ӧ�������С�ķ�Ӧ����Ӧ��������������ʵ�����С��ѹǿ��С������ϵѹǿ���䣬˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬��D����ȷ��
E����ͬʱ���ڣ�����0.1molNH3��ͬʱ������0.1molNO��˵�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬��E����ȷ��
�ʴ�Ϊ��BDE��
��2�����ڸ÷�ӦΪ���ȷ�Ӧ�������ݻ��̶��ľ����ܱ������з���������Ӧ�������������䣬��Ӧ�����з�Ӧ��ϵ���¶ȸ���ԭ��Ӧ���������淴Ӧ���ʶ����������Ũ�ȼ�С��ΪӰ�����Ҫ���أ����Է�Ӧ�������ʴ�Ϊ����ϵ�¶����ߣ���Ӧ��Ũ�ȼ�С��
��3�������ڴ�������ȫȼ����������Ⱦ����̬����ӦΪ������ˮ��1 mol����ȼ�շ���a kJ�����Ȼ�ѧ����ʽΪ6NH3(g)+3O2(g)=3N2(g)+6H2O(g) ��H=��6a kJ��mol-1��
��5�������ǰ����ڷ�Ӧ���ڼ��Ի����з�Ӧ�ĵ缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B�Ǻ˵����Ϊ1~18�е�Ԫ�أ�����Ȼ���к���AҪ����B�����ǵ�ԭ�ӵ��Ӳ�ṹ�����к�����������ǵ��Ӳ�����4�����ص㣬�ش��������⣺
��1��A��B��Ԫ�ط��ŷֱ��� A______��B_______
��2������B���ӽṹʾ��ͼ��_____
��3����A��BԪ����ɵ�����_____������ڡ������ڡ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�㶨�¶��£���һ��2L���ܱ������г���A���塢B���壬��Ũ�ȷֱ�Ϊ2 mol/L��1 mol/L���ҷ������·�Ӧ��3A(g)+2B(g) 4C(?)+2D(?)��֪��?������C��D״̬δȷ������Ӧһ��ʱ���ﵽƽ�⣬�������1.6 mol C���ҷ�Ӧǰ��ѹǿ��Ϊ5��4��������˵������ȷ���ǣ� ��
�ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ��![]()
�ڴ�ʱB��ת����Ϊ35%
���������ϵѹǿ��ƽ�������ƶ�������ѧƽ�ⳣ������
������C������A��Bת���ʲ���
A. �٢�B. �ڢ�C. �ۢ�D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪH2��O2��Ӧ����H2O(g)�������仯ʾ��ͼ�������й���������ȷ����

A. 1 mol H2���Ӷϼ���Ҫ����436 kJ������
B. H2(g)+1/2O2(g)��H2O(g) ��H����241.8 kJ/mol
C. ��Ӧ��������������������������
D. �γɻ�ѧ���ͷŵ��������ȶ��ѻ�ѧ�����յ�������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�ס������ص缫���϶���������̼������ش��������⣺
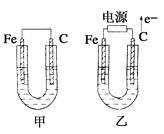
(1)�������е������Һ��ΪCuSO4��Һ����Ӧһ��ʱ���
���к�ɫ�����������Ǽ׳��е�________�����ҳ��е�________����
�ڼ׳��и����ĵ缫��Ӧʽ��____________________________________________��
(2)�������е������Һ��Ϊ����NaCl��Һ��
��д���ҳ����ܷ�Ӧ�����ӷ���ʽ��______________________________________________��
���ҳ�̼���ϵ缫��Ӧ����________(����������Ӧ��������ԭ��Ӧ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١������Ԫ�أ���д���пհף�
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
һ | �� | |||||||
�� | �� | �� | �� | |||||
�� | �� | �� | �� | �� | ||||
�� | �� |
(1)����ЩԪ���У���������ǿ����________(�����Ԫ�ط��ţ���ͬ)��
(2)������������ˮ�����У�������ǿ�Ļ�����Ļ�ѧʽ��________��
(3)����������������������Ԫ����________��д���������������������Ʒ�Ӧ�����ӷ���ʽ___________________________________________________________��
(4)�ۢܢݶ�Ӧ�ļ����Ӱ뾶��С�����˳��Ϊ��______________��
(5)����ۿ��γ�һ��18 e- �ķ��ӣ�д���÷��ӵĵ���ʽ��__________���÷����д���________(�������Լ��������Ǽ��Լ����������Ӽ���)��
(6)������γɵĻ��������ˮ��Ӧ����һ����ɫ���壬��ת��0.5mol����ʱ�����ɵ������ڱ�״���µ����Ϊ______L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ʵ�飬�ܴﵽʵ��Ŀ�ĵ���
A | B | C | D |
|
|
|
|
��֤��ѧ��ת��Ϊ���� | �о������Ի�ѧ��Ӧ���ʵ�Ӱ�� | ʵ�����ư��� | ��֤�ǽ����ԣ�Cl>C>Si |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʾ���з�Ӧ�����ӷ���ʽ��ȷ����
A. ��ǿ������Һ�д��������� Fe(OH)3 ��Ӧ���� Na2FeO4�� 3ClO3-��2Fe(OH)3 =2FeO42-��3Cl-��H2 O��4H+
B. ��Ũ������ MnO2 ��Ӧ��ȡ����������MnO2��2H+��2Cl-= Mn2+��Cl2����2H2O
C. �� NaAlO2 ��Һ��ͨ����� CO2 �� Al(OH)3��AlO2-��CO2��2H2O===Al(OH)3����HCO3-
D. ��������������ϡ���3Fe2+��4H+��NO3-===3Fe3+��NO2����3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������п�������ϡH2SO4��Ӧ��ȡ������һ���¶���Ϊ������Ӧ���ʶ��ֲ�Ӱ����������������������м���(����)
A.CH3COOK����B.CuCl2����C.KNO3��ҺD.����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com