
【题目】一定条件下,金属钠和CO2可制得金刚石:4Na+3CO2![]() 2Na2CO3+C(s,金刚石)
2Na2CO3+C(s,金刚石)
完成下列填空:
(1)上述反应中涉及的元素的原子半径从大到小的顺序为____。
(2)能证明碳元素与氧元素非金属强弱的事实是___(选填编号)。
a.最高价氧化物水化物的酸性 b.两种元素的气态氢化物的沸点
c.CO2中元素的化合价 d.气体氢化物受热分解的温度
(3)高压下,科学家成功地将CO2转化为具有类似SiO2结构的原子晶体,比较SiO2与CO2这两种原子晶体的熔沸点高低,并说明理由:___。
常压 | 熔点(℃) | 沸点(℃) |
钠 | 97.8 | 882.9 |
Na2CO3 | 851 | 1850分解 |
金刚石 | 3550 | … |
石墨 | 3850 | 4250 |
(4)若在2L密闭容器中,10min内金属钠减少了0.2mol,则CO2的平均反应速率为___。该反应在常压1000℃下进行,根据右表数据,该反应的平衡常数表达式K=___。
(5)若在2L密闭容器中,常压、1000℃下,起始时,下列物理量能说明该反应已达到平衡状态的是____。
a.气体的平均摩尔质量不变 b.3v消耗(Na)=4v生成(CO2)
c.气体的密度不变 d.![]() 的比值不变
的比值不变
【答案】Na>C>O cd CO2高,Si原子半径大于C原子,Si-O键键长大于C-O键键长,Si-O键键能低,因此溶沸点低于CO2 0.0075mol/(L·min) ![]() bc
bc
【解析】
可根据①同周期元素原子序数越大,原子半径越小,非金属性越强,其氢化物热稳定性越强,其最高价氧化物的水化物(最高价含氧酸)酸性越强。同样,同周期元素原子序数越大,原子半径越小,金属性越弱,其最高价氧化物的水化物碱性越弱。②CO2转化为具有类似SiO2结构的原子晶体后,不再存在单个CO2分子,结构发生了变化,属化学变化,物理及化学性质也大有变化,熔点大大升高,这两者不互为同分异构体。每个C有四个价电子,以单键结合四个O,形成空间网状结构。
(1)上述元素中,涉及到的元素有Na、C、O三种,有元素周期率可推出原子半径为Na>C>O。
故答案为Na>C>O。
(2)CO2中C元素化合价为+4价,O元素化合价为-2价,故可比较出O元素的化合价强于C,且非金属性越强,其氢化物热稳定性越强,故可以通过比较气体氢化物受热分解的温度。
故答案为cd
(3)CO2转化为具有类似SiO2结构的原子晶体后熔点大大升高,故CO2熔点高,Si原子半径大于C原子,Si-O键键长大于C-O键键长,Si-O键键能低,因此溶沸点低于CO2。
故答案为 CO2高,Si原子半径大于C原子,Si-O键键长大于C-O键键长,Si-O键键能低,因此溶沸点低于CO2
(4)由题意可计算Na的平均反应速率=0.2÷2÷10=0.01mol/L/min,由方程式可得4Na~3CO2,故CO2的平均反应速率为![]() ×0.01=0.075 mol/(L·min),反应在常压1000℃下进行,根据右表数据且在平衡常数表达式中,固体的浓度为常数,故平衡常数K=
×0.01=0.075 mol/(L·min),反应在常压1000℃下进行,根据右表数据且在平衡常数表达式中,固体的浓度为常数,故平衡常数K=![]() 。
。
故答案为0.0075mol/(L·min) ![]()
(5)由方程式4Na+3CO2![]() 2Na2CO3+C(s,金刚石)可知,反应过程中参与反应的气体只有CO2,故气体的平均摩尔质量不变不能说明反应达到平衡,故a选项错误。反应物消耗速率等与反应物生成速率时反应达到平衡,故3v消耗(Na)=4v生成(CO2)正确。气体CO2的密度不变说明二氧化碳的物质的量已经达到平衡,故反应达到平衡状态,c选项正确。
2Na2CO3+C(s,金刚石)可知,反应过程中参与反应的气体只有CO2,故气体的平均摩尔质量不变不能说明反应达到平衡,故a选项错误。反应物消耗速率等与反应物生成速率时反应达到平衡,故3v消耗(Na)=4v生成(CO2)正确。气体CO2的密度不变说明二氧化碳的物质的量已经达到平衡,故反应达到平衡状态,c选项正确。![]() 的比值等于系数之比,不变不等于反应达到平衡。
的比值等于系数之比,不变不等于反应达到平衡。
故答案为 bc


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去)
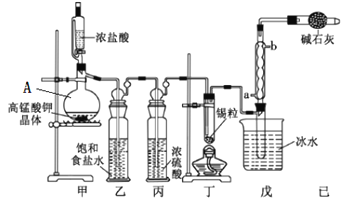
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | 33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)甲装置中仪器A的名称为___________。
(2)用甲装置制氯气,MnO4被还原为Mn2+,该反应的离子方程式为________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到__________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:①促进氯气与锡反应;②_______________________。
(4)乙装置的作用____________,如果缺少乙装置,可能发生的副反应的化学方程式为_________;己装置的作用是_____(填序号)。
A.防止空气中CO2气体进入戊装置
B.除去未反应的氯气,防止污染空气
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中不可用于检测是否产生SnCl2 的有_______(填序号)。
A.H2O2溶液 B.酸性高锰酸钾溶液 C.AgNO3溶液 D.溴水
(6)反应中用去锡粒1.19 g,反应后在戊装置的试管中收集到2.04 g SnCl4,则SnCl4的产率为_______(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
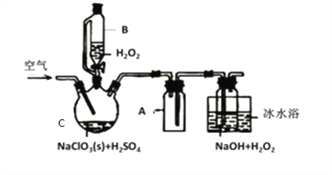
(1)仪器C的名称是__________________,仪器A的作用是_________________,冰水浴冷却的目的是_____________________和___________________________。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,___________;空气流速过快时,________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①_____________________________(用离子方程式表示)
②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为_________________。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。
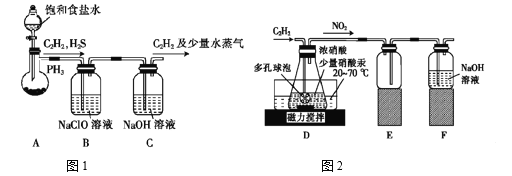
①电石与水反应很快,为了减缓反应速率,装置A中除用饱和食盐水代替水之外,还可以采取的措施是__________(写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为______。该过程中,可能产生新的杂质气体Cl2,其原因是: _____________(用离子方程式回答)。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是______________________。
②装置D中生成H2C2O4的化学方程式为____________________________。
③从装置D中得到产品,还需经过_____________(填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是______________________。
②滴定过程中发现褪色速率开始很慢后逐渐加快,分析可能的原因是_______________。
③产品中H2C2O4·2H2O的质量分数为_______________(列出含 m、c、V 的表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
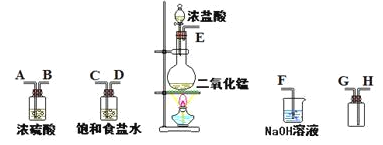
(1)连接上述仪器的正确顺序是(填各接口处的字母):E接 , 接 , 接 , 接 。___
(2)在装置中饱和食盐水起的作用是___。
(3)化学实验中检验是否有Cl2产生常用试纸为___。
(4)写出氢氧化钠溶液中反应的离子方程式___。
(5)将0.2molMnO2和500mL12mol/L盐酸混合后缓缓加热,MnO2反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为___(不考虑盐酸的挥发和氯气的溶解)。
(6)实验室也可以用K2Cr2O7和盐酸反应制取Cl2,配平反应方程式,并指出氧化剂和还原剂的物质的量之比是___,________K2Cr2O7+________HCl=________KCl+________CrCl3+________Cl2↑+________H2O
(7)已知还原性:SO32->I-。向含amolKI和amolK2SO3的混合液中通入bmolCl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是___
A.当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl-
B.当5a=4b时,发生的离子反应为4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl-
C.当a<b<![]() 时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b
时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b
D.当a≤b≤![]() 时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol
时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:
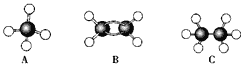
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是________(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是____________;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是________,生成水最多的是________。
(4)在120℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的含量影响钢铁性能。一种测定硫含量的方法是将钢样中硫转化为二氧化硫气体,再用测硫装置进行测定。某测定硫含量的流程如下:
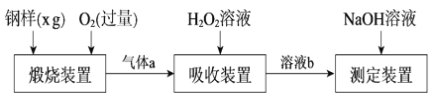
(1)气体a的主要成分有CO2、______、______。
(2)若钢样中硫以FeS的形式存在,煅烧装置中发生的化学反应为3FeS+5O2 ![]() 1______ +3______。___________
1______ +3______。___________
(3)吸收装置中,H2O2氧化SO2的化学方程式是_________________。
(4)用NaOH溶液中和生成的溶液b,消耗z mLNaOH溶液,若消耗1 mLNaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究Br2、I2能否将Fe2+氧化,实验如下。
实验 | 试剂x | 现象及操作 |
| 溴水 | i.溶液呈黄色,取出少量滴加KSCN溶液,变红 |
碘水 | ii.溶液呈黄色,取出少量滴加KSCN溶液,未变红 |
(1)实验ⅰ中产生Fe3+ 的离子方程式是________。
(2)以上实验体现出氧化性关系:Br2_______I2(填“>”或“<”)。
(3)针对实验ⅱ中未检测到Fe3+,小组同学I2 +2Fe2+ ![]() 2Fe3+ + 2I-(反应a),限度小,产生的c(Fe3+)低;若向ⅱ的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡向_____移动,c(Fe3+)增大。
2Fe3+ + 2I-(反应a),限度小,产生的c(Fe3+)低;若向ⅱ的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡向_____移动,c(Fe3+)增大。
(4)针对小组同学的分析,进行实验ⅲ:向ⅱ的黄色溶液中滴加足量AgNO3溶液。现象及操作如下:
Ⅰ.立即产生黄色沉淀,一段时间后,又有黑色固体从溶液中析出;取出少量黑色固体,洗涤后,_________(填操作和现象),证明黑色固体含有Ag。
Ⅱ.静置,取上层溶液,用KSCN溶液检验,变红;用CCl4萃取,无明显现象。
(5)针对上述现象,小组同学提出不同观点并对之进行研究。
① 观点1:由产生黄色沉淀不能判断反应a的平衡正向移动,说明理由:______。经证实观点1合理。
② 观点2:Fe3+ 可能由Ag+ 氧化产生。
实验ⅳ:向FeSO4溶液滴加AgNO3溶液,_____(填现象、操作),观点2合理。
(6)观点1、2虽然合理,但加入AgNO3溶液能否使反应a的平衡移动,还需要进一步确认。设计实验:取ⅱ的黄色溶液,______(填操作、现象)。由此得出结论:不能充分说明(4)中产生Fe3+的原因是由反应a的平衡移动造成的。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com