
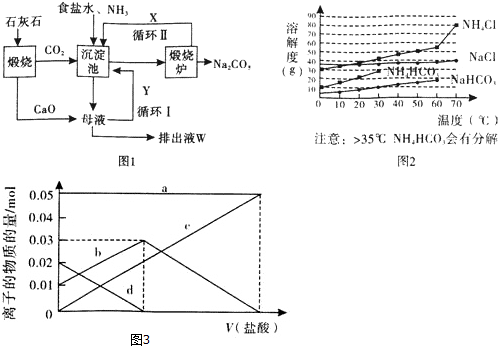
分析 由流程可知,碳酸钙受热分解生成氧化钙和二氧化碳,氧化钙进入母液,二氧化碳通入沉淀池,与氨气、食盐水反应生成NH4Cl、NaHCO3,在沉淀池中过滤分离出碳酸氢钠,煅烧炉内碳酸氢钠分解生成碳酸钠、水、二氧化碳,X为二氧化碳,可循环使用,母液中含氯化铵与氧化钙反应生成氨气,氨气为Y进行沉淀池继续进行循环利用.
(1)煅烧炉内分解的是碳酸氢钠,产物为CO2和水,沉淀池中通入的气体X为CO2;
(2)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,制取碳酸氢钠时先要得到含氨的饱和食盐水,所以应先通入氨气,氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵,;
(3)根据题中所给信息“35℃NH4HCO3会有分解”分析解答,根据影响反应速率的因素分析,要控制恒温;
(4)母液中含有氯化铵,加入石灰乳后可以生成氨气;
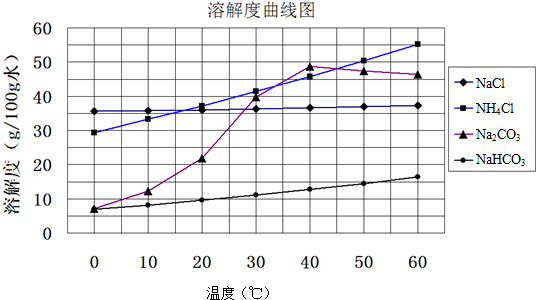
(5)混合物是碳酸钠和碳酸氢钠,滴入盐酸发生反应CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;依据图象分析碳酸根离子减小,碳酸氢根离子增多;根据碳、钠守恒计算Na2CO3的质量分数以及原NaHCO3的分解率.
解答 解:(1)沉淀池中,饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,煅烧炉内碳酸氢钠受热分解生成碳酸钠、CO2和水,可将CO2通入沉淀中循环利用,故X为CO2,
故答案为:CO2;
(2)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,制取碳酸氢钠时先要得到含氨的饱和食盐水,所以应先通入氨气,氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵,否则不能析出NaHCO3晶体,
故答案为:NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓;不能析出NaHCO3晶体;
(3)根据题意“35℃NH4HCO3会有分解”,所以温度不能超过35℃;同时反应速度受温度影响,温度太低反应速率太慢,所以温度必须控制在一个合理范围内,使温度保持一个恒定,
故答案为:NaHCO3溶解度小,低于300C反应速率慢,高于350C NaHCO3分解,不利于NaHCO3晶体析出;
(4)过滤后得到的母液中含有氯化铵,母液中加入石灰乳后,反应生成氨气,方程式为:CaO+2NH4Cl=CaCl2+2NH3↑+H2O,
故答案为:CaO+2NH4Cl=CaCl2+2NH3↑+H2O;
(5)碳酸氢钠受热分解生成二氧化碳、碳酸钠、水,反应为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,NaHCO3分解不完全,混合物是碳酸钠和碳酸氢钠,取加热了的NaHCO3样品2.96g 完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,发生反应 CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;溶液中有关离子的物质的量的变化为:碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,在此过程中,Na+不参与反应,浓度一直不变,故a曲线表示的是Na+浓度的变化,碳酸根离子减小,所以d曲线表示的是碳酸根离子浓度变化;碳酸根离子0.02mol;钠离子为0.05mol;样品中Na2CO3的物质的量为0.02mol,该样品中Na2CO3的质量分数为$\frac{0.02mol×84g/mol}{2.92g}$×100%≈71.62%,0.02mol的Na2CO3,分解的原NaHCO3为0.04mol,钠离子为0.05mol,样品2.96g中含NaHCO3为0.05mol,原NaHCO3的分解率为$\frac{0.04mol}{0.05mol}$×100%=80%,
故答案为:Na+;CO32-;71.62%;80%.
点评 本题考查了工业制纯碱的原理分析,生产过程中的物质变化,混合物成分的分析判断和计算应用,实验过程分析,图象定量分析判断,侧重分析与应用能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| D. | 金属氧化物一定不能与碱发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:1:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| B. | 向氯化银的悬浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| C. | 向0.0008mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42-完全沉淀 | |
| D. | 将0.001mol•L-1AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 反应物A的转化率 | B. | 平衡混合气中物质B的质量分数 | ||
| C. | 平衡混合气的密度 | D. | 平衡混合气中C的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
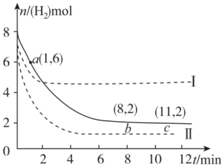
| A. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| B. | 曲线II对应的条件改变是降低压强 | |
| C. | 反应开始至a点时v(H2)=1mol•L-1•min-1 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<$\frac{8}{3}$mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com