
 Ag2O2↓+2KNO3+K2SO4+2H2O
Ag2O2↓+2KNO3+K2SO4+2H2O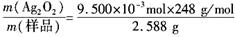 =0.91
=0.91

科目:高中化学 来源:不详 题型:填空题


 ),聚丙烯酸钠单体的结构简式是________;
),聚丙烯酸钠单体的结构简式是________;
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.升高温度,AgCl沉淀的溶解度减小 |
| D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解程度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2SO3△H<0
2SO3△H<0
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.5×10-16 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( )| A.2 | B.3 | C.4 | D.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.10 mL 0.2 mol/LNa2CO3溶液 | B.40 mL水 |
| C.50 mL 0.01 mol/L 氯化钡溶液 | D.100 mL 0.01 mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com