
| A.NaOH 和Ba(NO3)2 | B.Ca(OH)2和AgNO3 |
| C.NaOH和BaCl2 | D.Na2CO3和BaCl2 |
科目:高中化学 来源:不详 题型:单选题
| A.用CCl4萃取溴水中的溴分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏中,冷却水应从冷凝管的下口通入,上口流出 |
| C.用焰色反应检验Na+时,用玻璃棒蘸取试样置于火焰上灼烧观察火焰颜色 |
| D.蒸发结晶时,当加热到有大量固体出现时停止加热,用余热蒸干 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 |
| B.KNO3溶液(AgNO3):加过量KCl溶液,过滤 |
| C.NaCl溶液(Br2):加CCl4,分液 |
| D.KNO3溶液(NaCl):加热蒸发得浓溶液后,降温 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去CO2气体中混有的HCl气体:用NaOH溶液洗气后干燥 |
| B.除去NaOH固体中混有的Ca(OH)2:通入过量CO2,过滤、洗涤、干燥 |
| C.除去FeCl2溶液中混有的CuCl2:加入过量铁粉,过滤 |
| D.除去Cu粉中少量的铁:加稀硫酸溶解,过滤、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | A | B | C | D |
| 分散到水中 | 得悬浊液 | 得无色溶液 | 液体分层,且下层为无色油状液体 | 得无色溶液 |
| 熔点(℃) | 1452 | -21.3 | -11.5 | 801 |
| 沸点(℃) | 1703 | 78.9 | 117 | 1210 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
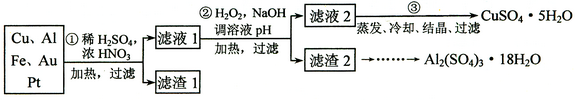
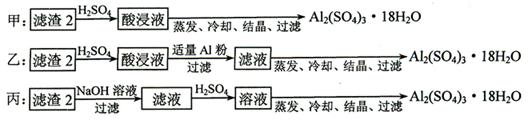
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com