
| A、反应后溶液pH下降 |
| B、通常用盐酸酸化的高锰酸钾溶液 |
| C、方框中粒子为NO2 |
| D、当生成1 mol Mn2+ 需消耗2.5 mol NO2- |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(K+)≥0.2 mol/L |
| B、一定存在的离子:Cl- CO32-、SO42- NH4+ |
| C、一定不存在的离子:Ca2+ K+ Cl- |
| D、c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
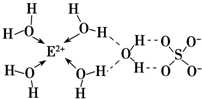
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1S22S22P2 |
| B、1S22S22P63S23P6 |
| C、1S22S22P5 |
| D、1S22S22P63S23P1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定有Al3+、SO42-,可能有K+、NH4+ |
| B、肯定无Fe2+、Mg2+、CO32-,可能有Al3+ |
| C、原溶液一定是明矾和MgSO4的混合溶液 |
| D、不能确定的离子只能通过焰色反应来确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:
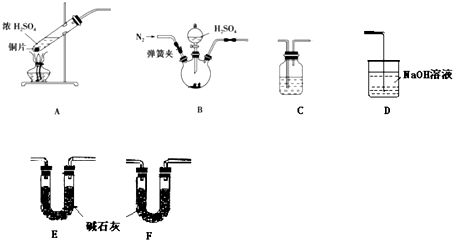
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com