
 认真读书,回归课本,请回答下列问题:
认真读书,回归课本,请回答下列问题:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、互为手性异构体的分子互为镜像,且分子组成相同,性质也相同 |
| B、由酸性FCH2COOH>CH3COOH,可知酸性ClCH2COOH>CH3COOH |
| C、由AgCl和AgBr都能溶于氨水中,而AgI不能溶解在氨水中,可知AgI在水中的溶解度更大 |
| D、除HF外,其他卤化氢沸点随相对分子质量增大而升高,是因为氢键的键能逐渐增大所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:
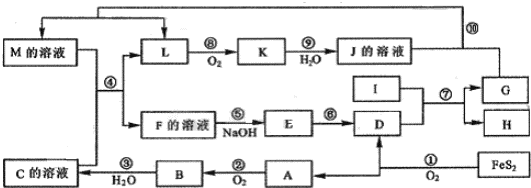
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2Y在电离时:H2Y+H2O?HY-+H3O+ |
| B、在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+) |
| C、在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |
| D、HY-水解方程式为:HY-+H2O?Y2-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④①⑤ |
| B、②①③⑤④ |
| C、②①⑤④③ |
| D、②①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/m g | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com