
| A.新制氯水的氧化性强于久置氯水 |
| B.某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,说明该溶液中有钙离子 |
| C.用NaOH除去混在Cl2中的HCl气体 |
| D.用水和Al2O3混合制取Al(OH)3 |
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源:不详 题型:实验题
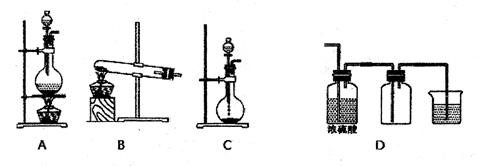

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.液体分层,上层为四氯化碳层,黄色 |
| B.液体分层,上层为水层,紫色 |
| C.液体分层,下层为四氯化碳层,紫色 |
| D.液体分层,下层为水层,黄色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
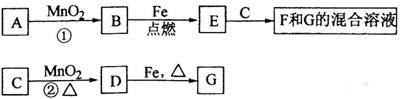
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.次氟酸分子中原子间以共价键相结合 | B.次氟酸分解会产生氟气 |
| C.次氟酸与热水反应可能有H2O2生成 | D.次氟酸的酸性可能比次氯酸强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
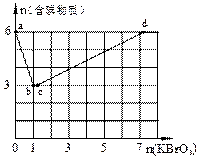
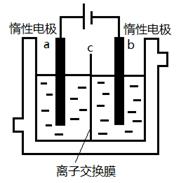
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
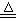 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O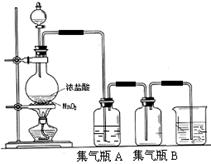
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等于0.3mol | B.小于0.3mol |
C.大于0.3mol,小于0.6 mol mol | D.等于0.6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com