
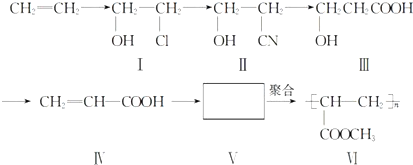
 .(提示:该反应的逆反应原子利用率为100%)
.(提示:该反应的逆反应原子利用率为100%)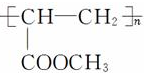 ;
; 分析 根据IV和VI结构简式知,IV发生酯化反应生成V,V结构简式为CH2=CHCOOCH3,
(1)目前工业上生产乙烯主要是以石油为原料通过裂化和裂解反应来实现;
(2)化合物Ⅲ生成化合物Ⅳ的副产物为发生酯化反应生成物;
(3)从化合物Ⅳ到化合物Ⅵ的两步反应方程,第一步发生酯化反应,第二步发生加聚反应;
(4)A.化合物Ⅲ含有醇羟基和羧基,具有醇和羧酸性质;
B.化合物Ⅲ含有羧基,能和NaOH发生中和反应;
C.化合物Ⅳ含有碳碳双键,能和氢气发生加成反应;
D.化合物Ⅲ中含有醇羟基和羧基,能和钠反应,Ⅳ和Ⅴ不含羧基和羟基;
E.化合物Ⅳ和Ⅴ都含有碳碳双键,都能发生加成反应;
F.化合物Ⅴ含有酯基,能发生水解反应.
解答 解:根据IV和VI结构简式知,IV发生酯化反应生成V,V结构简式为CH2=CHCOOCH3,
(1)目前工业上生产乙烯主要是以石油为原料通过裂化和裂解反应来实现,故答案为:石油;裂化、裂解;
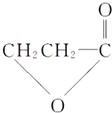
(2)化合物Ⅲ生成化合物Ⅳ的副产物为发生酯化反应生成物,结构简式为 ,故答案为:
,故答案为: ;
;
(3)从化合物Ⅳ到化合物Ⅵ的两步反应方程,第一步发生酯化反应,第二步发生加聚反应,反应方程式依次为CH2═CH-COOH+CH3OH$?_{△}^{浓硫酸}$CH2═CH-COOCH3+H2O、nCH2═CH-COOCH3$\stackrel{一定条件下}{→}$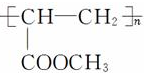 ,故答案为:CH2═CH-COOH+CH3OH$?_{△}^{浓硫酸}$CH2═CH-COOCH3+H2O;nCH2═CH-COOCH3$\stackrel{一定条件下}{→}$
,故答案为:CH2═CH-COOH+CH3OH$?_{△}^{浓硫酸}$CH2═CH-COOCH3+H2O;nCH2═CH-COOCH3$\stackrel{一定条件下}{→}$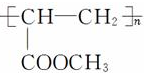
;
(4)A.化合物Ⅲ含有醇羟基和羧基,具有醇和羧酸性质,可以发生氧化反应,故正确;
B.化合物Ⅲ含有羧基,能和NaOH发生中和反应,故错误;
C.化合物Ⅳ含有碳碳双键,能和氢气发生加成反应,故正确;
D.化合物Ⅲ中含有醇羟基和羧基,能和钠反应,Ⅳ和Ⅴ不含羧基和羟基,不能和钠反应,故错误;
E.化合物Ⅳ和Ⅴ都含有碳碳双键,都能发生加成反,所以都与溴发生加成反应,故正确;
F.化合物Ⅴ含有酯基,能发生水解反应,故正确;
故选ACEF.
点评 本题考查有机物推断,为高频考点,明确官能团及其性质关系是解本题关键,知道常见官能团发生的反应,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中的两种物质互为同素异形体 | |
| B. | 反应②中HCNO是氧化剂 | |
| C. | 反应②中N2既是氧化产物,又是还原产物 | |
| D. | 反应②中NO2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:4 | C. | 1:2 | D. | 4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com