
【题目】某化学小组进行Na2O2与水反应的实验,如下图所示,该小组对试管c中红色褪去的原因进行探究。
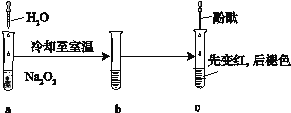
(1)Na2O2中含有的化学键类型:__________;请写出a中反应的化学方程式______。
查阅资料:
①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;
②Na2O2与水反应分两步进行:Na2O2+ H2O =" NaOH" + H2O22H2O2= 2H2O + O2↑
(2)请设计实验验证Na2O2与水反应后的溶液中有H2O2残留:取少量b溶液于试管中,____________,证明溶液中有H2O2残留。
(3)结合资料,该小组同学针c中溶液红色褪去的原因提出以下假设:
①_____________________;
② 溶液中H2O2破坏酚酞的结构;
③ NaOH和H2O2共同作用结果。
(4)该小组同学测出c中溶液的pH为14,认为还不能排除假设②、③,于是又进行了如下实验,请完成下表空白处:
实验 | 操作 | 现象 | 结论 |
1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ①___________ |
2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 |
|
3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12…… | ②_____________________________…… | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时, NaOH和H2O2共同作用使溶液褪色 |
(5)某同学按取(4)中述实验2褪色后的溶液,加水稀释至pH=12,没有观察到溶液变红。该同学推测实验2加盐酸后溶液变红还可能与温度有关,请写出理由:___________。
【答案】离子键、非极性共价键 2Na2O2 + 2H2O = 4NaOH + O2↑ 加入少量MnO2粉末,产生大量气泡,用带火星的木条检验,木条复燃 溶液中NaOH浓度较大,pH≥13 仅H2O2不能破坏酚酞结构,酚酞褪色是H2O2和NaOH共同作用结果(或 假设②不正确,假设③正确) 溶液先变红,后褪色; 加入稀盐酸,会因发生中和反应而放热,使溶液温度升高
【解析】
(1)Na2O2中含有的化学键类型有离子键、非极性共价键;Na2O2与水反应生成氢氧化钠和氧气,化学方程式为2Na2O2 + 2H2O = 4NaOH + O2↑
(2)证明过氧化氢的存在,利用其在二氧化锰作催化剂的条件下发生分解反应,生成氧气来判断。操作步骤是加入少量MnO2粉末,产生大量气泡,用带火星的木条检验,木条复燃。
(3)当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;所以① 的假设是溶液中NaOH浓度较大,pH≥13;
(4)实验1的现象说明①仅H2O2不能破坏酚酞结构,酚酞褪色是H2O2和NaOH共同作用结果;
实验3的结论说明Na2O2与水反应后的溶液(pH=14>13),所以滴加2滴酚酞先变红后褪色;加入盐酸使氢氧根离子浓度减小,又出现红色,pH在8~13时,NaOH和H2O2共同作用使溶液褪色,所以最终溶液褪色。
(5)加水稀释不变红,加盐酸后变红,因为加盐酸后发生中和反应,中和反应是放热反应,体系温度升高,溶液红色出现。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.溴水中存在Br2+H2O![]() HBr+HBrO,加入AgNO3溶液,溴水褪色
HBr+HBrO,加入AgNO3溶液,溴水褪色
B.对于平衡2SO2+O2![]() 2SO3,使用催化剂有利于SO3的合成
2SO3,使用催化剂有利于SO3的合成
C.醋酸稀溶液加热后溶液pH降低(不考虑醋酸受热挥发)
D.合成氨时适当增大压强有利于提高氮气的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应:mA+nB![]() pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是合成聚对苯二甲酸—1,4—丁二醇酯的合成路线图:

(1)实验室制备乙炔的方程式为______。
(2)化合物A的结构简式为______。
(3)③的反应类型为______。
(4)写出反应⑥的化学方程式______。
(5)D有多种同分异构体,符合以下条件的共有______种,写出其中一种同分异构体的结构简式______。
①能发生水解反应,遇饱和FeCl3溶液显色;
②1mol该同分异构体能与足量银氨溶液生成4mol Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性条件下有如下反应:![]() 由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或
由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或![]() ,两者都是红色固体.一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
,两者都是红色固体.一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
实验现象 | 红色固体和蓝色溶液 | 无色气体和蓝色溶液 | 无色气体和蓝色溶液 | 红棕色气体和蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物是![]()
A.CuB.![]()
C.一定有Cu,可能有![]() D.一定有
D.一定有![]() ,可能有Cu
,可能有Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生反应:A(g)+3B(g)![]() 2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
A. 用B表示反应速率为0.3 mol·L-1·s-1
B. 平衡后,向容器中充入无关气体(如Ne),反应速率增大
C. 3s时生成C的物质的量为1.2mol
D. 平衡后,v(正)(A)=v(逆)(A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
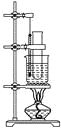
(1)反应需在50℃~60℃的温度下进行,图中给反应物加热的方法是________,其优点是________和________;
(2)在配制混合酸时应将__________加入到________中去;
(3)该反应的化学方程式是___________________________________________;
(4)由于装置的缺陷,该实验可能会导致的不良后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命法写出下列物质名称或结构简式
(1)C4H10的一氯代物有_____________种。
(2)某有机物含C、H、O三种元素,分子模型如图所示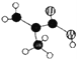 (图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_______,所含官能团的名称为 __________。
(图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_______,所含官能团的名称为 __________。
(3)常温下,已知0.1 mol·L-1一元酸HA溶液中![]() =1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________;写出该酸(HA)与NaOH溶液反应的离子方程式: _______________________________。
=1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________;写出该酸(HA)与NaOH溶液反应的离子方程式: _______________________________。
(4)25℃时,已知Ksp[Fe(OH)3]=8×10-38,则0.01mol/L FeCl3溶液中欲使Fe3+沉淀,求溶液所需的最小pH=________。(用对数形式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:

已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:____________________________。
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是_______________(填化学式)。
(3)除杂步骤中加入的MnCO3的作用是____________________________,该过程需调节溶液pH的范围是___________________________,若把pH调得过高,其后果是_________________________。
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为____________________,电解后阳极的电解质溶液可返回_______________________(填“酸浸”“除杂”或“电解”)工序继续使用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com