
| A. | 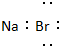 | B. |  | C. |  | D. |  |
分析 A.溴化钠为离子化合物,离子方程式中需要标出阴阳离所带电荷;
B.氯化镁为离子化合物,阴阳离子需要标出所带电荷,阴离子需要标出最外层电子;
C.次氯酸中不存在氢氯键,其分子中存在1个氧氢键和1个氧氯键;
D.二氧化碳分子中含有两个碳氧双键,碳原子最外层为8个电子.
解答 解:A.溴化钠为离子化合物,电子式中钠离子直接用离子符号表示,溴离子需要标出最外层电子及所带电荷,溴化钠正确的离子方程式为: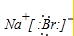 ,故A错误;
,故A错误;
B.氯化镁为离子化合物,氯离子需要标出最外层电子,氯化镁的电子式为: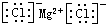 ,故B错误;
,故B错误;
C.次氯酸为共价化合物,分子中不存在氢氯键,次氯酸的电子式为: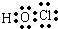 ,故C正确;
,故C正确;
D.二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ,故D错误.
,故D错误.
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的区别.


科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
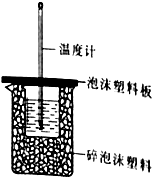 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4,少量X |
| 实验现象 (间) | A大于B(填大于或小于) | |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| T | 基态原子3d轨道上有1个电子 |
| X |  |
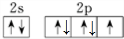
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=z | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l)△H=-5518kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com