
 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题: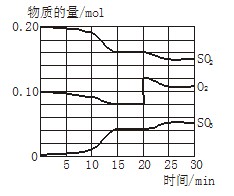


科目:高中化学 来源:不详 题型:计算题
 C(g)达到平衡时,C的体积分数为40%。试回答有关问题。
C(g)达到平衡时,C的体积分数为40%。试回答有关问题。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 bB(g)达到平衡后,保持温度不变,将容器体积缩小一半,当达到新平衡时,B的浓度是原来的1.6倍,则( )
bB(g)达到平衡后,保持温度不变,将容器体积缩小一半,当达到新平衡时,B的浓度是原来的1.6倍,则( )| A.平衡向正反应方向移动了 | B.物质A的转化率增大了 |
| C.物质B的质量分数减小了 | D.A>b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 bB(g)+cC(g),在温度不变的条件下,再充入一定量的A,重新达到平衡时,下列判断中正确的是
bB(g)+cC(g),在温度不变的条件下,再充入一定量的A,重新达到平衡时,下列判断中正确的是| A.若a=b+c时,B的物质的量分数变大 | B.若a=b+c时,B的物质的量分数不变 |
| C.若a>b+c时,A的转化率不变 | D.若a<b+c时,A的转化率变大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
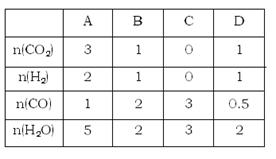
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
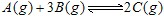 达到平衡的标志的是:
达到平衡的标志的是:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NO2(g) ΔH=+52.70 kJ·mol—1。在恒温、恒容的密闭容器中进行上述反应,达到平衡时,描述中不正确的是
2NO2(g) ΔH=+52.70 kJ·mol—1。在恒温、恒容的密闭容器中进行上述反应,达到平衡时,描述中不正确的是| A.若再向容器内继续通入少量N2O4,则平衡向正反应方向移动 |
| B.新平衡时,NO2的体积分数小于原平衡时NO2的体积分数 |
| C.新平衡时,容器中气体的平均相对分子质量比原平衡大 |
| D.新平衡时,混合气体颜色变浅,容器中气体的密度增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 5C(g),起始时4个容器所盛A2和B2的量如下表所示:
5C(g),起始时4个容器所盛A2和B2的量如下表所示:| 容量 | 甲 | 乙 | 丙 | 丁 |
| A2(mol) | 2 | 1 | 2 | 1 |
| B2(mol) | 1 | 1 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OH(g),甲醇生成量与时间的关系如图所示。下列有关说法正确的是.
CH3OH(g),甲醇生成量与时间的关系如图所示。下列有关说法正确的是.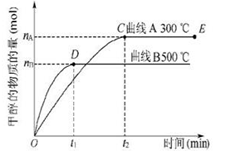
| A.在300 ℃条件下,t1时刻该反应达到化学平衡 |
| B.在500 ℃条件下,从反应开始到平衡,氢气的平均反应速率v(H2)为nB/(3t1) mol/L |
| C.在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,则氢气的浓度减小 |
| D.由图像说明该反应的正反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com