
| A. | 石油裂化、石油分馏、石油裂解、石油的催化重整都是化学变化 | |
| B. | 分子式为C3H4Cl2的有机物中,与乙烯含有相同官能团的共有5种 | |
| C. | 高纯度的晶体硅可以制备晶体管等半导体、电脑芯片和光导纤维 | |
| D. | 酒精、NaCl溶液、CuSO4溶液、浓HNO3都可使蛋白质发生变性 |
分析 A.石油分馏是物理变化;
B.分子式为C3H4Cl2且含有 结构的有机物,可以看作两个Cl原子取代了丙烯中两个H形成的,丙烯不存在同分异构体,丙烯的一氯代物有:CH2Cl-CH=CH2、CH3-CCl=CH2、CH3-CH=CHCl,然后分别用Cl原子取代1个H既可以得到丙烯的二氯代物,注意去掉重复的结构;
结构的有机物,可以看作两个Cl原子取代了丙烯中两个H形成的,丙烯不存在同分异构体,丙烯的一氯代物有:CH2Cl-CH=CH2、CH3-CCl=CH2、CH3-CH=CHCl,然后分别用Cl原子取代1个H既可以得到丙烯的二氯代物,注意去掉重复的结构;
C.制备光导纤维的不是晶体硅,而是SiO2;
D.NaCl属于无机轻金属盐,不会导致蛋白质变性.
解答 解:A.石油分馏是物理变化,故A错误;
B.①先不考虑Cl,写出C3H6的链状同分异构体,只有一种结构:CH3-CH=CH2
②由于CH3-CH=CH2 只有三种氢,所以有三种一氯代物:CH2Cl-CH=CH2、CH3-CCl=CH2、CH3-CH=CHCl
③再以上述每一种产物为母体,写出二元取代产物:
CH2Cl-CH=CH2 的取代产物有三种:CHCl2-CH=CH2,CH2Cl-CCl=CH2,CH2Cl-CH=CHCl
CH3-CCl=CH2 的取代产物有两种:CH2Cl-CCl=CH2 (重复),CH3-CCl=CHCl
CH3-CH=CHCl 的取代产物有三种:CH2Cl-CH=CHCl (重),CH3-CCl=CHCl (重),CH3-CH=CCl2
所以分子式为C3H4Cl2链状有机物的同分异构体共有5种,故B正确;
C.高纯度的晶体硅可以制备晶体管等半导体、电脑芯片,制备光导纤维的不是晶体硅,而是SiO2,故C错误;
D.酒精、CuSO4溶液、浓HNO3都可使蛋白质发生变性,NaCl属于无机轻金属盐,不会导致蛋白质变性,而是盐析,故D错误;
故选B.
点评 本题考查了同分异构体的书写、化工生产、物质性质的分析应用,注意知识的积累,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
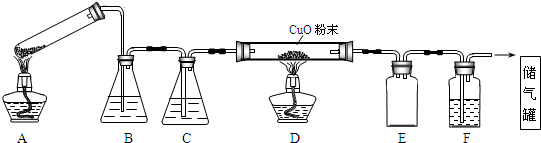
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 步骤 | 实验方案 | 预期现象和结论 |
| ① | 用药匙取少许样品粉末,加入试管A中,再用胶头滴管取过量的NaOH溶液加入试管A中,充分反应后,静置.弃去上层清液,剩余固体备用. | 粉末部分溶解,并有气体放出,则合金中一定含有铝 |
| ② | 向试管A的剩余固体中加入过量的稀硫酸充分反应后,静置,取上层清液于试管B中,剩余固体备用. | 固体部分溶解,并有气体放出,溶液呈浅绿色,则合金中可能含有 铁. |
| ③ | 在试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变成黄色,加KSCN后显血红色,结合②可知,一定含铁 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色沉淀产生,则合金中一定含有铜. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | NaHSO4 | C. | CH3COONa | D. | CH3COONH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
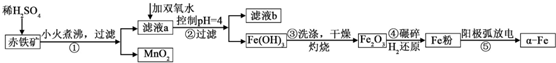
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁条与稀H2SO4反应 | |
| B. | 乙醇在氧气中的燃烧反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl | |
| D. | 炽热的焦炭和水蒸气反应制取水煤气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L或4.48L | B. | 2.24L或6.72L | C. | 4.48L或8.96L | D. | 6.72L或8.96L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com