
现有七种短周期主族元素,其原子序数按A、B、C、D、E、F、G的顺序递增。A元素的最高正化合价和最低负化合价的代数和等于0,且A是形成化合物种类最多的元素;C原子能形成分别含10电子、18电子的两种阴离子,且C与F位于同一主族;D单质投入冷水中反应缓慢,投入沸水中迅速产生气泡;E的简单阳离子是同周期元素所形成的简单离子中半径最小的。回答下列问题:
(1)B位于周期表第 周期第 族。
(2)元素M位于E与F元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池。M、F、G的气态氢化物的稳定性由强到弱的顺序为 (用化学式表示)。
(3)若选择三种试剂设计实验能证明非金属性:B>A>M,用化学方程式表示实验原理: 。
(4)下列实验方法能证明D与E的金属性强弱关系的是 。
A.比较D和E的单质分别与稀硫酸反应产生气泡的快慢
B.比较D和E的单质分别与同浓度的氢氧化钠溶液反应产生气泡的快慢
C.比较D和E的单质分别与氯气、氧气、硫等非金属单质反应的产物
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年四川省高一上入学考化学试卷(解析版) 题型:计算题
成都市近年来常常发生“毒奶粉”事件。劣质奶粉制造商为牟取暴利,大大降低了奶粉中蛋白质的含量,导致食用这种奶粉的众多婴幼儿严重营养不良乃至死亡。
为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质。其原理是把蛋白质中的氮元素完全转化为氨气(化学式为NH3),再用稀硫酸吸收氨气,反应的化学方程式为:2 NH3+H2SO4= (NH4)2 SO4
现取该奶粉样品100g,用“盖尔达法”分解其中的蛋白质,产生的氨气用7.5g溶质质量分数为19.6%的稀硫酸恰好完全吸收。
计算并回答下列问题:
(1)产生氨气的质量是多少?(计算结果精确到0.01,下同)
(2)含氮元素的质量多少?
(3) 该奶粉中氮的含量是否达到了国家规定的标准。(奶粉中蛋白质的含量国家标准为:每100g婴幼儿奶粉中含12g~25g。蛋白质含氮元素的质量分数为16%)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一上开学考化学卷(解析版) 题型:选择题
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是
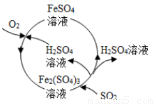
A.该过程中可得到化工产品H2SO4
B.该工艺流程是除去煤燃烧时产生的SO2
C.该过程中化合价发生改变的元素为Fe和S
D.图中涉及到的反应之一为Fe2(SO4)3 + SO2 + 2H2O == 2FeSO4 + 2H2SO4
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期第一次月考化学试卷(解析版) 题型:选择题
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随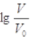 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是
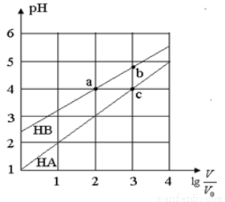
A.该温度下HB的电离平衡常数约等于1.11×10-5
B.相同条件下NaA溶液的pH大于NaB溶液的pH
C.溶液中水的电离程度:a=c>b
D.当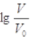 =3时,若两溶液同时升高温度,则
=3时,若两溶液同时升高温度,则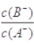 减小
减小
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述中,正确的是
A. 14C中含有14个中子
B. 1H、2H、3H是同一种核素
C. H2O与D2O(重水)互称同位素
D. C60、C70、金刚石、石墨均为碳的同素异形体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上开学考化学试卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
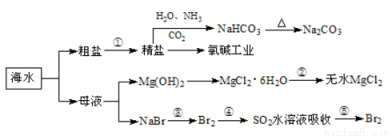
下列有关说法正确的是
A.在第③、④、⑤步骤中,溴元素均被氧化
B.制取NaHCO3的反应是利用其在此反应所涉及物质中溶解度最小
C.用澄清的石灰水可鉴别NaHCO3和Na2CO3
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上开学考化学试卷(解析版) 题型:选择题
从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法,不正确的是

A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含I—的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
C.在碘水中加入几滴淀粉溶液,溶液变蓝色
D.碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上8月开学考化学试卷(解析版) 题型:填空题
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
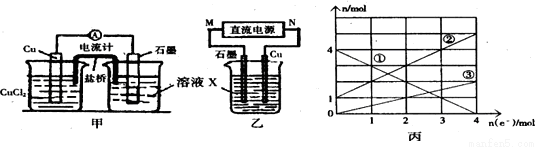
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是 ;②Cu电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 离子(填“K+”或“Cl—”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极;②图丙中的②线是 离子的变化。
③当电子转移为2mol时,向乙烧杯中加入 L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
③Na2FeO4能消毒、净水的原因 。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期周考(8.28)化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是()
A.60gSiO2含有的Si-O共价键数为2NA
B.常温常压下,1Llmol/L的亚硫酸钠溶液中的SO32-为NA
C.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
D.1.5molNO2与足量H2O反应,转移的电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com