
 A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知:
A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知:分析 A、B、C、D、Z为周期表前四周期元素,原子序数依次递增.已知:①A为元素周期表中原子半径最小的元素,则A为H元素;②B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子排布为1s22s22p2,则B为C元素;③D的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,D为O元素;结合原子序数可知,C为N元素;④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同,原子序数为22,则Z为Ti元素;⑤A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,则M为HCHO,N为C6H6,据此解答.
解答 解:A、B、C、D、Z为周期表前四周期元素,原子序数依次递增.已知:①A为元素周期表中原子半径最小的元素,则A为H元素;②B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子排布为1s22s22p2,则B为C元素;③D的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,D为O元素;结合原子序数可知,C为N元素;④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同,原子序数为22,则Z为Ti元素;⑤A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,则M为HCHO,N为C6H6.
(1)化合物M为HCHO,碳原子的孤电子对数为0,碳原子的σ键数为3,则碳原子采取sp2杂化,空间结构为平面三角形,化合物N为苯,由苯分子直接构成的,则N在固态时的晶体类型为分子晶体,
故答案为:平面三角形;sp2;分子晶体;
(2)B、C、D三种元素的分别为C、N、O,同周期元素从左到右元素的第一电离能呈增大趋势,则C元素的最小,但N原子的电子排布中2p轨道为半满稳定状态,能量较低,则失去1个电子更难,第一电离能高于O元素,故第一电离能C<O<N,
故答案为:C<O<N;
(3)与CO2互为等电子体的分子为N2O,
故答案为:N2O;
(4)由C、N、O三种元素所组成的CNO-离子在酸性条件下可与NaClO反应,生成N2、CO2等物质.上述反应的离子方程式为:2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O,
故答案为:2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O;
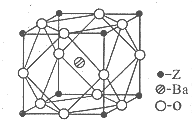
(5)Z为Ti,核外电子数为22,原子基态时的电子排布式为:1s22s22p63s23p63d24s2,外围电子排布式为3d24s2,由晶体结构图可知,晶体内与每个Z原子等距离且最近的氧原子在棱的位置,关于Z原子对称,则氧原子数为3×2=6,Ba原子数目为1,Ti原子数目为$8×\frac{1}{8}=1$,O原子数目为$12×\frac{1}{4}$=3,故化学式为BaTiO3,
故答案为:3d24s2;6; BaTiO3.
点评 本题是对物质结构的考查,涉及分子结构、杂化轨道、电离能、核外电子排布式、晶胞结构等,推断元素是解题关键,注意理解同周期元素中第一电离能发生异常情况,难度中等.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化硅是一种重要的结构陶瓷材料,具有优良性能.
氮化硅是一种重要的结构陶瓷材料,具有优良性能.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维和计算机芯片的材料都是二氧化硅 | |
| B. | 蛋白质只含C、H、O、N四种元素 | |
| C. | 可用酸性高锰酸钾溶液除去乙烷中的乙烯 | |
| D. | 液溴易挥发,在存放液溴的试剂瓶中应加水“液封” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
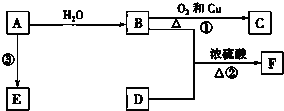 已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.
已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.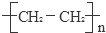 ,反应类型:加聚反应.
,反应类型:加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
| A. | T1<T2 | |
| B. | K2=1.35 mol•L-1(或K2=1.35) | |
| C. | 混合气体的密度始终保持不变 | |
| D. | 乙容器中,当反应进行到1.5 min时,n(H2O)=1.4 mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO-) | |
| C. | 浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3•H2O)+c(NH4+)=0.1mol/L | |
| D. | pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com