
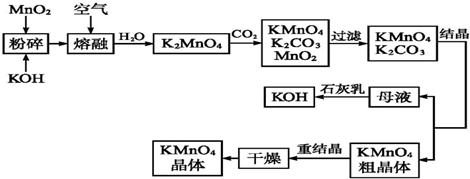
分析 二氧化锰与氢氧化钾在空气中熔融,加水溶解得到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,过滤除去滤渣(MnO2),滤液为KMnO4、K2CO3溶液,浓缩结晶,趁热过滤得到KMnO4晶体,母液中含有K2CO3,在母液中加石灰乳(氢氧化钙)得到碳酸钙沉淀和KOH.
(1)KMnO4具有强氧化性,以此进行判断;
(2)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+;
(3)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水;
(4)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,所含元素化合价升高的反应物是还原剂;
(5)母液中含有K2CO3,在母液中加石灰乳(氢氧化钙)得到碳酸钙沉淀和KOH;
(6)制备中利用的原料,在转化过程中又生成的可以循环利用;
(7)最初的原料中1mol MnO2恰好得到1mol K2MnO4,根据3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2计算.
解答 解:二氧化锰与氢氧化钾在空气中熔融,加水溶解得到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,过滤除去滤渣(MnO2),滤液为KMnO4、K2CO3溶液,浓缩结晶,趁热过滤得到KMnO4晶体,母液中含有K2CO3,在母液中加氢氧化钙得到碳酸钙沉淀和KOH,
(1)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,
故答案为:BD;
(2)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+,则反应的离子方程式为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O;
故答案为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O;
(3)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2 $\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2 $\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
(4)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,反应只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,所以K2MnO4既是氧化剂又是还原剂,
故答案为:K2MnO4;
(5)母液中含有K2CO3,在母液中加石灰乳(氢氧化钙)得到碳酸钙沉淀和KOH,离子方程式为:CO32-+Ca(OH)2=CaCO3+2OH-,
故答案为:CO32-+Ca(OH)2=CaCO3+2OH-;
(6)制备中利用的原料,在转化过程中又生成的可以循环利用.由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用,
故答案为:KOH;MnO2;
(7)由2MnO2+4KOH+O2 $\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O 可知最初的原料中1mol MnO2恰好得到1mol K2MnO4,由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到$\frac{2}{3}$molKMnO4,
故答案为:$\frac{2}{3}$.
点评 本题考查了物质的制备实验方案设计,涉及常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:填空题
 和
和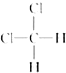 E.正丁烷和异丁烷 F.2,2-二甲基丁烷和正戊烷
E.正丁烷和异丁烷 F.2,2-二甲基丁烷和正戊烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等 | B. | 前者小 | C. | 前者大 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A. | ③④ | B. | ①③④ | C. | ②⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com