
| A. | 1molS2C12价电子数为66NA | |
| B. | 氧化产物与还原产物的物质的量之比为l:7 | |
| C. | 每生成l mol SO2转移4 NA电子 | |
| D. | 每生成48g硫单质会断裂5NA共价键 |
分析 反应2S2Cl2+2H2O=4HCl+SO2↑+3S↓中,S元素的化合价由+1价升高为+4价,S元素的化合价由+1价降低为0,以此对各选项进行判断.
解答 解:A.1molS2C12价电子数为(6+7)×2NA=26NA,故A错误;
B.氧化产物为SO2,还原产物为S,由反应可知二者的物质的量比为1:3,故B错误;
C.S元素的化合价由+1价升高为+4价,则每生成1molSO2转移3mol电子,故C错误;
D.48gS的物质的量为:$\frac{48g}{32g/mol}$=1.5mol,根据反应可知,生成1.5molS需要消耗1molCl-S-S-Cl和1molH2O,1molCl-S-S-Cl中含有3mol共价键,1mol水分子中含有2mol共价键,所以每生成48g硫会断裂5mol共价键,故D正确;
故选D.
点评 本题考查氧化还原反应的应用,为高频考点,题目难度中等,明确反应中元素的化合价变化为解答的关键,试题侧重分析与应用能力的考查.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中加入足量稀盐酸无现象,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中有SO42- |
| B | Agl沉淀中滴入稀KCl溶液 | 有白色沉淀生成 | AgCl比AgI更难溶 |
| C | 向CH3CH2X中加入少量AgNO3溶液,加热 | 有浅黄色沉淀生成 | CH3CH2X中含有Br- |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | KMnO4溶液褪色 | 使KMnO4溶液褪色的是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
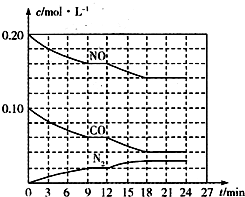 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要. )+c(HSO
)+c(HSO )(用含硫微粒浓度的代数式表示).
)(用含硫微粒浓度的代数式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水时放出的热量为57.3 kJ | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)=FeS(s)△H=-95.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
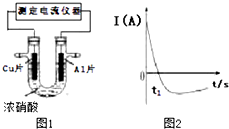 常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生.下列说法不正确的是( )
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生.下列说法不正确的是( )| A. | 0-t1时,正极的电极反应式为:2H++NO3--e-═NO2+H2O | |
| B. | 0-t1时,溶液中的H+向Cu电极移动 | |
| C. | t1时,负极的电极反应式为:Cu-2e-═Cu2+ | |
| D. | t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | 全部 | C. | ①②③⑥⑦ | D. | ②③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com