
【题目】在元素周期表中,元素A、B位于同周期,A在ⅡA族,B在ⅢA族。A的原子序数为x,B的原子序数为y,不可能是
A. y=x+1 B. y=x+10
C. y=x+11 D. y=x+25
科目:高中化学 来源: 题型:
【题目】实验室制硝基苯的主要步骤如下:
① 在250mL的圆底烧瓶中放入17.7 mL苯,配上一个双孔橡皮塞,一个孔插入一支100℃温度计,其水银球要进入液面下,另一个孔插入长颈漏斗,仪器装置如图所示。

②通过长颈漏斗上口将已配制好的混酸分多次加入烧瓶中。每加一次,必须振荡烧瓶,当反应物温度不再上升而趋下降时,才可继续加混酸。反应温度应保持在40—50℃,若超过50℃,可用冷水浴冷却烧瓶,加料完毕后,把烧瓶放在水浴上加热,约10分钟内把水浴加热到55-60℃,并保持30分钟,间歇地振荡烧瓶。
③冷却后将反应物倒入分液漏斗,静置分层,分出酸液和粗硝基苯,由于工业浓H2SO4中含有少量汞盐等杂质有催化作用,使反应产物中含有苦味酸(2,4,6-三硝基苯酚)和2,4-二硝基苯酚使粗硝基苯呈浅黄色,此外还含有间二硝基苯。已知:苦味酸与2,4-二硝基苯酚均有酸性,能与碱反应;间二硝基苯性质与硝基苯类似。请回答下列问题
(1)步骤①中长颈漏斗的作用
a _______________________,b _______________。
(2)步骤 ②中,每加入一次混酸,必须振荡烧瓶的目的_____________________。
(3)步骤②中,需严格控制温度的原因___________________________________。
(4)步骤③中,静置分层后,粗硝基苯在分液漏斗_____ 层。
(5)要将粗硝基苯中混有少量酸液、苦味酸、2,4一二硝基苯酚以及二硝基苯,除去得到纯净的硝基苯必须进行的五步操作名称为a __________ 、 b _____________、c _________ 、 d _____________、e_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A. 测0.1 mol/L氨水的pH为11:NH3·H2O![]() NH+OH-
NH+OH-
B. 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-
+OH-
C. 用CuCl2溶液做导电实验,灯泡发光:CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
D. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe﹣2e-=Fe 2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X的气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素
A. 在周期表中处于第三周期ⅦA族 B. 在周期表中处于第二周期ⅤA族
C. 氢化物稳定性比PH3弱 D. 常见化合价只有-3、+2、+3、+5价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某溶液中Ca2+的含量,某冋学设计了如下实验:量取100 mL该溶液于烧杯中,加入足量的(NH4)2C2O4溶液使Ca2+转化为CaC2O4沉淀(假设其他离子均不生成沉淀),过滤、洗涤后,往沉淀中加入足量稀硫酸,然后用0.1000molL-1的KMnO4标准溶液滴定。
(1)配平KMnO4氧化H2C2O4的化学方程式:____________________
(2)如图所示的仪器中,配制0.1000molL-1的KMnO4标准溶液时肯定不需要的是___(填标号),除此之外还需用到的玻璃仪器是___(填仪器名称)。

(3)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1000molL-1(填“>”、“<”或“=”,下同);若KMnO4标准溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___0.1000molL-1。
(4)若滴定过程中消耗KMnO4标准溶液20.00mL,则原溶液中Ca2+的质量浓度为___gL-1。
(5)下图为草酸钙固体在受热分解过程中所得固体产物的质量随温度变化的曲线,图中A、B、C分别代表三种固体,写出固体A到B的化学方程式:_________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为LiCoO2 +6C![]() li1-xCoO2 +lixC6,结构如图所示。下列说法正确的是
li1-xCoO2 +lixC6,结构如图所示。下列说法正确的是
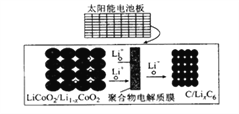
A. 放电时,正极质量增加
B. 充电时,锂离子由右向左移动
C. 该钾离了电池工作时,涉及到的能量形式有3 种
D. 充电时、阳极的电极反应式为Li1-xCoO2+xLi++xe-= LiCoO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“比较”是化学研究物质性质的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:2Na2O2+2CO2=2Na2CO3+O2, Na2O2+CO=Na2CO3。则Na2O2与SO2反应的化学方程式为( )
A.SO2+Na2O2=Na2SO4B.2SO2+2Na2O2=2Na2SO3+O2
C.SO2+Na2O2=Na2SO3D.SO2+Na2O2=Na2SO4 +O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为
A. ![]() B.
B. ![]()
C. ![]() D. 1 000VρM(MV+2 240)
D. 1 000VρM(MV+2 240)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com