
【题目】某无色溶液含有下列离子中的若干种:H+、Fe3+、Ba2+、Al3+、CO32-、Cl-、OH-,向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有
A. 3种 B. 4种 C. 5种 D. 6种
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I.(1)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中先后发生甲、乙两个反应,实现了I-与IO-之间的转化,请依次写出发生反应的离子方程式,反应甲:______________;反应乙:____________。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图_______。

II.(2)Fe2+与Ag+在溶液中可以发生氧化还原反应。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如图所示:
①用离子方程式表示Fe(NO3)2溶液中发生的反应___________________________________。
②据A点数据,计算该转化反应的平衡常数为____________________。
③用下图的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是__________________。石墨为电池的_____极,通过列式计算说明原因_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
Ⅰ.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________。
Ⅱ.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

(2) “酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4生成1molPbSO4转移电子的物质的量为____________mol。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示:
NaHPbO2(aq),其溶解度曲线如图所示:

②粗品PbO中所含杂质不溶于NaOH溶液。
结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量__________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,___________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl2的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。

①阴极的电极反应式为_______________________。
②电解一段时间后,Na2PbCl4浓度极大减小,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铁溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是
A. Fe(OH)3 Fe2O3 B. Fe(OH)2 Fe2O3
C. Fe(OH)2 Fe(OH)3 D. Fe(OH)2 Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(沸点65℃)是一种可再生能源,具有广泛的开发和应用前景。
(1)常温下,1g甲醇完全燃烧生成液态水时放出22.7kJ的热量,写出表示甲醇燃烧热的热化学方程式 ________________________________________________。
(2)现有反应CO(g)+2H2(g) =CH3OH(g)过程中能量变化如图所示,写出该反应的热化学方程式_______________________________;

该反应在不同温度下的化学平衡常数 K(250℃)____K(350℃)(填“大于”或“小于”),
若恒温恒容下,将3molCO和6molH2充入密闭容器中进行该反应,反应达到平衡,测得容器内压强为开始时的0.6倍,CO的转化率为_______。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH- =2CO32-+6H2O,则负极的电极反应式为:________________________。
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:_____________;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH-物质的量浓度为0.01 molL-1(25℃下测定),则理论上消耗氧气的体积为_________mL(标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 任何晶体中,若含有阳离子也一定含有阴离子
B. 分子晶体中只存在分子间作用力,不含有其他化学键
C. 离子晶体中只含有离子键,不含有共价键
D. 原子晶体中只含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如图所示,其中充满NO2的试管是( )。
A. 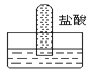
B. 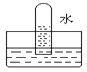
C. 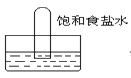
D. 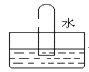
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com