
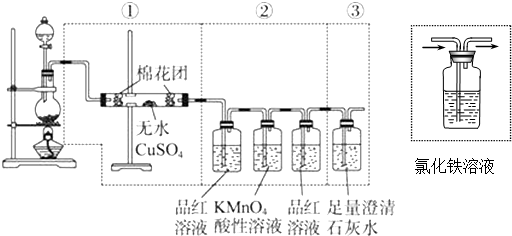
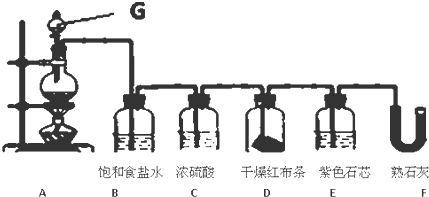
分析 (1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水,据此写出反应的化学方程式;
(2)i.装置①用无水硫酸铜检验水,无水硫酸铜变蓝说明有水生成;
ii.装置②中前一瓶品红溶液褪色证明混合气体中存在二氧化硫;
iii.检验二氧化碳气体时必须排除二氧化硫的干扰,即:②中第二个品红溶液不褪色,然后再根据③中澄清石灰水是否变浑浊判断;
(3)二氧化碳和二氧化硫均可以使澄清的石灰水变浑浊;
(4)铁离子与二氧化硫发生氧化还原反应生成硫酸根离子、亚铁离子和水,据此写出反应的离子方程式;反应后的溶液中含有硫酸根离子,加入氯化钡后生成硫酸钡沉淀;
(5)检验氯化铁溶液中的亚铁离子,不能使用硫氰化钾,可以利用亚铁离子的还原性,通过加入酸性高锰酸钾进行判断.
解答 解:(1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)i.装置①用于检验水,则无水硫酸铜变蓝说明有水生成,
故答案为:无水硫酸铜变蓝;水;
ii.二氧化硫检验漂白性,能够使品红溶液褪色,所以装置②中前一瓶品红溶液褪色证明混合气体中存在二氧化硫,
故答案为:SO2(或二氧化硫);
iii.二氧化硫和二氧化碳都能够使澄清石灰水变浑浊,当②中第二个品红溶液不褪色,证明二氧化硫已经除尽,若③中澄清石灰水变浑浊,则证明混合气体中存在二氧化碳气体,
故答案为:②中第二个品红溶液不褪色,③中澄清石灰水变浑浊;
(3)如果将仪器的连接顺序变为①、③、②,①可以确定水的存在,但是③既可以是二氧化碳的性质又可以是二氧化硫的性质,
故答案为:H2O;CO2、SO2;
(4)二氧化硫具有 还原性,能够与铁离子发生氧化还原反应,反应的离子方程式为:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+;反应后④的溶液中含有硫酸根离子,加入氯化钡后反应生成硫酸钡沉淀,反应的离子方程式为:SO42-+Ba2+=BaSO4↓,
故答案为:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+;SO42-+Ba2+=BaSO4↓;
(5)Fe2+具有还原性,能使酸性KMnO4溶液褪色,若④中的氯化铁溶液含有少量的亚铁离子,为检验少量亚铁离子的存在,可以使用酸性高锰酸钾溶液检验,而不能使用硫氰化钾溶液、稀盐酸和氢氧化钠,故C正确,
故答案为:C.
点评 本题考查了浓硫酸的性质,题目难度中等,注意掌握铜与浓硫酸反应的原理,明确常见气体的性质及检验方法,特别是加入试剂的先后顺序,(5)为易错点,注意溶液中含有铁离子,无法用硫氰化钾、氯水溶液检验亚铁离子.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH2COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验目的 | 污水的体积(mL) | 温度(℃) | 过氧化氢的质量分数 |
| ① | 为以下实验作参照 | 25 | 20 | 10% |
| ② | 过氧化氢浓度的影响 | 25 | 20 | 30% |
| ③ | 温度的影响 | 25 | 80 | 10% |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe2+ | 7.4 | 8.9 |
| Fe3+ | 2.2 | 3.2 |
| 实验步骤 | 预期现象及结论 |
| 第一步,取少量废水于试管中,滴加几滴KSCN溶液,振荡,观察现象. | 如果无现象,则假设一成立,如果溶液变红,则进行下一步实验 |
| 另取少量废水于试管中,滴加少量的KMnO4酸性溶液,振荡,观察现象 | 如果紫色退去,则假设三成立;如果紫色未退去,则假设二成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
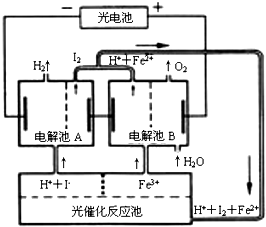
| A. | 外电路中每通过0.2 mol电子,电解池B中就会生成1.12L氧气 | |
| B. | 光催化反应池中离子反应式是:2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I- | |
| C. | 电解池B中阴极反应式是:Fe3++e-═Fe2+ | |
| D. | 电解池A的阳极反应式是:2I--2e-═I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1 2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸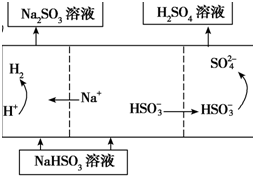 |
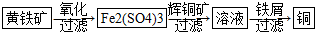
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 含有共价键的化合物不可能是离子化合物 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
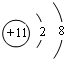 ;1124Na.
;1124Na.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com