
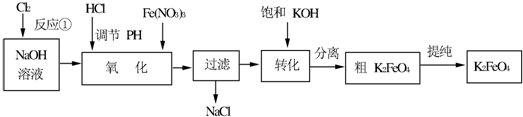

分析 (1)氯气是酸性气体,能和烧碱溶液反应生成NaCl和NaClO;
(2)从难溶电解质的沉淀转化的角度分析;
(3)①寻找最佳温度要具备的条件:该温度下反应速率快,生成高铁酸钾的产率较大两方面;
②从盐类的水解角度分析;
③根据反应物和生成物书写反应的离子方程式;
(4)选择的洗涤剂应能抑制K2FeO4的水解,并注意减少K2FeO4的溶解.
解答 解:(1)氯气是酸性气体,能和烧碱溶液反应,反应实质为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)根据反应Na2FeO4+2KOH=K2FeO4+2NaOH可知,反应生成溶解度更小的物质,说明此温度下Ksp(K2FeO4)<Ksp(Na2FeO4),故答案为:<;
(3)①寻找最佳温度要具备的条件:该温度下反应速率快,生成高铁酸钾的产率较大两方面,所以工业生产中最佳温度为26℃,因为在该温度下生成高铁酸钾的产率最大,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为$\frac{330}{275}$=1.2,故答案为:26;1.2;
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,原因是NaClO水解呈碱性,Fe(NO3)3水解呈酸性,二者发生互促水解,反应的离子方程式为3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO,
故答案为:3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO;
③碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,反应的离子方程式为2FeO42-+Fe3++8OH-=3FeO43-+4H2O,故答案为:2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
(4)为抑制K2FeO4的水解,应在碱性条件下洗涤,可用CH3COONa,为防止K2FeO4的溶解,可用异丙醇洗涤,故答案为:B.
点评 本题考查物质的制备方案的设计,为高频考点,解答本题时注意把握题给信息,注重知识迁移能力的培养,侧重分析与实验能力的考查,题目难度中等.


 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 14.4 g | B. | 11.6 g | C. | 8.8 g | D. | 3.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; | 第一次 | 第二次 | 第三次 | 第四次 |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键是分子内原子间的相互作用 | |
| B. | 含有阴离子的化合物一定含有阳离子 | |
| C. | 离子化合物熔点一定比共价化合物高 | |
| D. | 非金属元素组成的一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
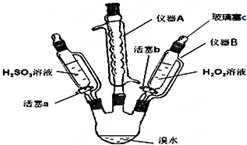 为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去).请回答下列问题:
为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去).请回答下列问题:| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| Ⅰ | 打开活塞a,逐滴加入H2SO3溶液至过量 | 橙黄色褪去 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 | 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 | H2O2的氧化性大于Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的气态氢化物比W的气态氢化物更稳定 | |
| B. | Z的氧化物能与盐酸反应,不能与NaOH溶液反应 | |
| C. | 原子半径按X、R、W、Z、Y的顺序依次增大 | |
| D. | X、Y、Z的最高化合价数值均等于其主族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com