
【题目】(1)写出下列反应的离子方程式:
①硫酸和氢氧化钠溶液反应___;
②少量二氧化碳通入澄清石灰水___;
③碳酸钙和盐酸反应___;
④氯化钠和硝酸银反应___。
(2)写出符合下列离子反应的化学方程式:
①CO32-+Ba2+=BaCO3↓___;
②Cu2++Fe=Cu+Fe2+___。
【答案】H++OH-=H2O CO2+Ca2++2OH-=CaCO3↓+H2O CaCO3+2H+=Ca2++H2O+CO2↑ Cl-+Ag+=AgCl↓ Na2CO3+BaCl2=BaCO3↓+2NaCl Fe+CuCl2=Cu+FeCl2
【解析】
(1) ①硫酸和氢氧化钠溶液反应生成硫酸钠和水,化学方程式为H2SO4+2NaOH=Na2SO4+2H2O,离子方程式H++OH-=H2O;故答案为:H++OH-=H2O;
②少量二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O,反应的离子方程式为:![]() ;故答案为:
;故答案为:![]() ;
;
③碳酸钙和盐酸反应生成CaCl2、H2O和CO2,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑;故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
④氯化钠和硝酸银反应生成AgCl沉淀和NaNO3,反应的化学方程式为NaCl+AgNO3=AgCl↓+NaNO3,离子方程式为Ag++Cl-=AgCl↓;故答案为:Ag++Cl-=AgCl↓;
(2) ①![]() 表示可溶性碳酸盐与可溶性钡盐反应生成碳酸钡沉淀,对应的化学方程式可以为:
表示可溶性碳酸盐与可溶性钡盐反应生成碳酸钡沉淀,对应的化学方程式可以为:![]() ,故答案为:
,故答案为:![]() 合理即可
合理即可![]() ;
;
②![]() 表示Fe与可溶性铜盐反应生成Cu和可溶性亚铁盐,对应的化学方程式可以为:
表示Fe与可溶性铜盐反应生成Cu和可溶性亚铁盐,对应的化学方程式可以为:![]() ,故答案为:
,故答案为:![]() 合理即可
合理即可![]() 。
。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】对反应A+B=AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol
②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL
④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是
A.②>①>④>③B.④>③>②>①
C.①>②>④>③D.①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中加入HBr,在一定条件下发生反应∶2HBr(g)![]() Br2(g)+H2(g), c(HBr)随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②、③,下列说法正确的是( )
Br2(g)+H2(g), c(HBr)随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②、③,下列说法正确的是( )
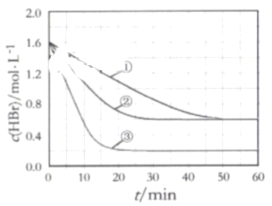
A.该反应正反应为放热反应
B.曲线①,0~ 50 min用H2表示的平均反应速率为0.02 mol﹒L-1﹒min-1
C.曲线②,可能使用了催化剂或增大了压强
D.曲线③达到平衡时,往容器中加入浓度均为0.2 mol﹒L-1的三种物质,平衡将向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应![]() 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时![]() 和
和![]() 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
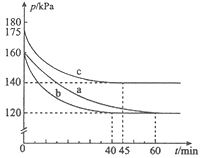
A. 实验c条件下,从反应开始至达到平衡时![]()
B. 实验a条件下,用浓度表示的平衡常数为100
C. 该反应的![]()
D. 比较实验a、c可判断升高温度反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较酸性相对强弱:H2SO4______HClO4(填“>”、“=”或“<”),已知能发生反应:H2SO4(浓)+NaClO4![]() HClO4+NaHSO4,说明该反应能发生的理由_______。
HClO4+NaHSO4,说明该反应能发生的理由_______。
(2)Al(OH)3具有一元弱酸的性质,在水中电离时产生的含铝微粒具有正四面体结构,写出电离方程式_______。
(3)甘氨酸和硝基乙烷的熔点分别为240°C和-40°C,从物质结构角度解释甘氨酸熔点较高的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
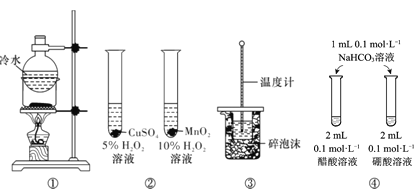
A.方案①用于分离I2和NH4Cl固体
B.方案用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热
D.方案④用于比较醋酸和硼酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2 s时测得C的浓度为0.6 mol·L-1,填写下列空白:
(1)用物质A表示反应的平均速率为_________。
(2)用物质B表示反应的平均速率为_________。
(3)2 s时物质A的转化率为_________。
(4)2 s时物质B的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是( )
A.食用油和白酒都应密封保存
B.高温下铝粉和氧化铁的反应可以用来焊接铁轨
C.电影放映时射到银幕上的光柱证明存在气溶胶
D.钢铁锈蚀、食物腐败、钟乳石的形成均涉及氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com