
| A. | 反应的化学方程式为:CO+H2O?CO2+H2 | |
| B. | 升高温度,v(正)、v(逆)都增大,且v(逆)增大更多 | |
| C. | 缩小容器体积,v(正)、v(逆)都增大,且v(正)增大更多 | |
| D. | 升高温度或缩小容器体积,混合气体的平均相对分子量都不会发生改变 |
分析 A.化学平衡常数中,分子中各物质是生成物、分母中各物质是反应物;
B.升高温度,正逆反应速率都增大,平衡向吸热方向移动;
C.缩小容器体积,增大压强,正逆反应速率都增大,平衡向气体体积减小的方向移动;
D.反应前后气体计量数之和不变,所以升高温度、缩小体积混合气体的物质的量不变.
解答 解:A.化学平衡常数中,分子中各物质是生成物、分母中各物质是反应物,所以反应方程式为:CO2+H2?CO+H2O,故A错误;
B.升高温度,正逆反应速率都增大,平衡向吸热方向移动,升高温度,氢气浓度减小,说明平衡正向移动,则正反应是吸热反应,所以v正增大更多,故B错误;
C.缩小容器体积,增大压强,正逆反应速率都增大,平衡向气体体积减小的方向移动,该反应前后气体体积不变,所以压强不影响平衡移动,则v(逆)、v(正)增大相同,故C错误;
D.反应前后气体计量数之和不变,所以升高温度、缩小体积混合气体的物质的量不变,根据质量守恒定律知,反应前后气体质量不变,所以混合气体平均相对分子质量都不变,故D正确;
故选D.
点评 本题考查化学平衡有关知识,为高频考点,涉及化学反应速率影响因素、化学平衡移动等知识点,明确外界条件对化学反应速率、化学平衡影响原理是解本题关键,注意该反应方程式特点,题目难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | X能形成化学式为H2XO4的酸 | |
| B. | X能与某些金属元素形成化合物 | |
| C. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| D. | X可能形成化学式为KXO3的盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.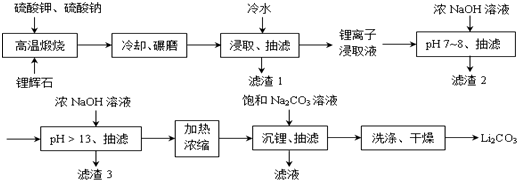
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CCl4提取碘水中的碘 | |
| B. | 用NaOH溶液除去溴苯中的溴 | |
| C. | 用酒精除去苯酚中的甘油 | |
| D. | 用饱和Na2CO3溶液除去乙酸丁酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
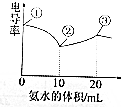 电导率可用于衡量电解质溶液导电能力的大小.室温下,用0.1000mol/L氨水滴定10mL浓度均为0.100mol/L的盐酸和醋酸的混合液,电导率曲线如图所示.下列说法错误的是( )
电导率可用于衡量电解质溶液导电能力的大小.室温下,用0.1000mol/L氨水滴定10mL浓度均为0.100mol/L的盐酸和醋酸的混合液,电导率曲线如图所示.下列说法错误的是( )| A. | ①点溶液中c(H+)为0.200 mol/L | |
| B. | ②点溶液中c(Cl-)>c(NH4+)>c(Ac-) | |
| C. | ①点溶液中n(所有离子)之和>③点溶液n(所有离子)之和 | |
| D. | ③点后会出现pH=7的点,此点溶液中c(NH4+)=c(Ac-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤液化制得清洁能源 | B. | 用酒精测试仪检测酒驾 | ||
| C. | 将氯气通入冷的消石灰中制漂白粉 | D. | 从海水中提取氯化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b}{(a+b)×1{0}^{7}}$ | B. | $\frac{b}{(a-b)×1{0}^{7}}$ | C. | $\frac{b}{(a-b)×1{0}^{5}}$ | D. | $\frac{a-b}{a×1{0}^{7}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com